
Не антибактериальная растительная терапия (BNO 1045) в сравнении с антибактериальной терапией (фосфомицина трометамол)
при лечении острых неосложненных инфекций нижних мочевыводящих путей у женщин: двойное слепое, в параллельных группах, рандомизированное многоцентровое исследование неменьшей эффективности фазы III
Флориан М. Вагенленер (Florian M. Wagenlehner)a, Дмитрий Абрамов-Соммарива (Dimitri Abramov-
Sommariva)b, Мартина Гёллер (Martina H.ller)b, Губерт Штайндль (Hubert Steindl)b, Курт Г. Набер
(Kurt G. Naber)c
a. Клиника урологии, детской урологии и андрологии, Университет им. Юстуса Либиха, г. Гисен, Германия.
b. Компания .Бионорика СЕ. (Bionorica SE), г. Ноймаркт, Германия.
c. Мюнхенский технический университет, г. Штраубинг, Германия.
Ключевые слова
- Инфекция мочевыводящих путей
- Симптоматическое лечение
- Растительные лекарственные препараты
- Антибиотики
Аннотация
Вступление. Цель данного рандомизированного контролируемого клинического исследования неменьшей эффективности III фазы заключается в том, чтобы подтвердить неменьшую эффективность растительного лекарственного препарата Канефрон® Н (BNO 1045) в сравнении с фосфомицина трометамолом (ФТ) для лечения острых неосложненных инфекций нижних мочевыводящих путей (нИН- МП).
Материалы и методы. Женщины 18–70 лет, у которых была впервые диагностирована острая нИНМП с типичными симптомами, были рандомизированы для приема BNO 1045 (n = 325) или ФТ (n = 334) и соответствующе- го плацебо. Первичной конечной точкой была процентная доля пациенток, дополнительно получавших антибиотики (АБ) для лечения нИНМП в период между Днем 1 и Днем 38 ± 3.
Результаты. В период между Днем 1 и Днем 38238 пациенток (83,5 %) в группе применения BNO 1045 и 272 пациентки (89,8 %) в группе применения ФТ не принимали дополнительных АБ. При пределе неменьшей эффективности, составляющем 15 %, BNO 1045 продемонстрировал неменьшую эффективность в сравнении с ФТ при лечении нИНМП (разница в показателе неприменения АБ составила –6,26 %; 95%-й доверительный интервал [ДИ] — от –11,99 % до –0,53 %; p-значение при применении двустороннего критерия = 0,0014). Частота возникновения нежелательных явлений была одинаковой в обеих группах, хотя в группе применения ФТ отмечалась более высокая частота нарушений со стороны желудочно-кишечного тракта, а в группе BNO 1045 — более высокая частота пиелонефрита. На протяжении исследования не было случаев смерти пациенток или прекращения лечения вследствие нежелательного явления, вызванного применением препарата.
Выводы. Препарат BNO 1045 обладает потенциалом снизить потребление АБ при лечении нИНМП и, следовательно, может существенно повлиять на стратегию рационального применения противомикробной терапии. Регистрационный номер исследования: NCT02639520; номер в Европейском реестре клинических исследований (EudraCT): 2013-004529-99.
Вступление
Инфекции мочевыводящих путей (ИМП) принадлежат к наиболее распространенным инфекционным заболеваниям в общей медицинской практике 1,2. В 80 % слу- чаев эти инфекции классифицируются как неосложненные ИМП (нИМП) 3. В современных протоколах лечения острых нИМП рекомендуется в качестве терапии первой линии применять антибиотики (АБ) 4.
Однако частое применение АБ может привести к нарушению микробиома 5 и увеличить риск антибиотикорезистентности 6.
Примерно в 80 % случаев нИМП у женщин, в остальном здоровых, вызывает бактерия Escherichia coli (E. coli) 2. Международные данные свидетельствуют, что в настоящее время устойчивость E. coli к большинству общеупотребительных АБ превышает 25 %. В частности, при внутрибольничных ИМП устойчивость к ципрофлоксацину составляет около 45,5 %, к триметоприму/сульфаметоксазолу — около 48,2 %, к аминопенициллину — около 50,4 % 7.
Чтобы предотвратить чрезмерное потребление АБ и, следовательно, усиление устойчивости к противомикробным препаратам, необходимо найти эффективные заменители АБ для лечения нИМП. В предыдущих исследованиях сравнивалась эффективность АБ и альтернативных препаратов, таких как нестероидные противовоспалительные препараты (НПВП) ибупрофен 8,9 и диклофенак 10, при этом были получены многообещающие результаты с точки зрения эффективности. Тем не менее неменьшую эффективность таких препаратов еще предстоит подтвердить.
Лекарственные препараты на растительной основе представляют собой еще одну потенциальную альтернативу антибиотикам для лечения нИМП. Стэйндж (Stange) и соавт. 11 опубликовали результаты клинического исследования, в ходе которого сравнивали фитокомбинацию корня хрена обыкновенного и настурции с антибиотиком (ко-тримоксазолом) для лечения острых нИМП у муж- чин и женщин. Хотя при сравнении этих двух препаратов неменьшая эффективность доказана не была, результаты продемонстрировали потенциал растительных препаратов в качестве альтернативы антибиотикам.
Канефрон® Н (далее — BNO 1045) зарегистрирован как растительный лекарственный препарат в 28 странах, включая Германию, Россию и Украину. Препарат BNO 1045 представляет собой покрытые оболочкой таблетки, содержащие измельченный золототысячник (Centaurii herba), измельченный корень любистка (Levistici radix) и измельченные листья розмарина (Rosmarini folium). Фармакологические данные относительно BNO 1045, документально подтвержденные в ряде экспериментальных моделей in vivo и in vitro, свидетельствуют о том, что препарат оказывает противовоспалительное 12.13, спазмолитическое 14, антиадгезивное 12 и антиноцицептивное действие 15, а также обладает диуретическими свойствами 16. В отличие от АБ, подобных фосфомицину, которые существенно изменяют состав микробиома, BNO 1045 в значительной степени сохраняет микробиоту кишечника 17.Это имеет особое значение в связи с результатами недавних исследований микробиоты мочевыводящих путей, согласно которым асимптоматическая бактериурия играет важную защитную роль при ИМП, что можно было бы использовать при разработке стратегии профилактического лечения рецидивирующих инфекций 18.
Безопасность и эффективность BNO 1045 были продемонстрированы в проводившемся ранее нерандомизированном многоцентровом открытом пилотном исследовании с участием пациентов с острыми неосложненными инфекциями нижних мочевыводящих путей 19. В этом исследовании у 71,2 % пациентов отмечался клинический ответ на применение BNO 1045 в качестве монотерапии, при этом препарат в целом хорошо переносился.
Цель настоящего клинического исследования заключалась в том, чтобы продемонстрировать неменьшую эффективность BNO 1045 в сравнении с АБ-терапией, определяемую по процентной доле пациенток, которые в ходе исследования дополнительно получали АБ для лечения нИНМП, а также оценить безопасность и переносимость BNO 1045 у пациенток с острыми нИНМП. Антибиотик фосфомицин (в виде фосфомицина трометамола [ФТ]) был выбран в качестве препарата сравнения, поскольку в современных клинических руководствах Европейской ассоциации урологов (ЕАУ) он рекомендуется в качестве препарата первой линии (в однократной пероральной дозе 3 г) 4.
Методы
Дизайн исследования
Данное исследование было двойным слепым с двойной имитацией (маскировкой; double-dummy) контролируемым рандомизированным многоцентровым международным исследованием неменьшей эффективности в параллельных группах, проводилось в 51 европейском исследовательском центре: в 16 центрах в Германии, 22 центрах на Украине и 13 центрах в Польше (номер EudraCT — 2013-004529- 99, регистрационный номер на сайте clinicaltrials.gov — NCT02639520). Исследование было утверждено всеми со- ответствующими инстанциями и комитетами по вопросам этики.
Пациенты
Пациентами, отвечающими критериям для участия в исследовании, были женщины 18–70 лет, у которых суммарный показатель «Шкалы оценки типичных симптомов острого цистита» (англ. ACSS: Acute Cystitis Symptom Score) по 3 основным симптомам нИМП (дизурия, поллакиурия и неотложные позывы к мочеиспусканию) по состоянию на День 1 составлял ≥ 6 баллов, а также был получен положительный результат анализа на лейкоцитарную эстеразу, что свидетельствует о лейкоцитурии. Пациентки должны были иметь выраженные симптомы не долее 6 дней до Дня 1, быть готовыми отказаться от приема лекарственных препаратов и продуктов, запрещенных протоколом исследования. К участию в исследовании допускались женщины, перенесшие хирургическую стерилизацию, пребывающие в периоде постменопаузы или готовые пользоваться высокоэффективными методами контрацепции на протяжении клинического исследования. Пациентки не включались в исследование, если признаки или симптомы, имеющиеся у них по состоянию на День 1, указывали на осложненную ИМП, пиелонефрит и (или) вульвовагинит; если у них были заболевания, способные привести к осложнению инфекции, или в анамнезе имелась рецидивирующая инфекция мочевыводящих путей. Все пациентки подписали форму информированного согласия на участие в исследовании. Главными критериями включения/ невключения1 в исследование были следующие.
Критерии включения
- Пациенты женского пола в возрасте 18–70 лет с общим баллом ≥ 6 для 3 основных симптомов ИНМП (дизурия, поллакиурия и ургентность) по разделу типичных жалоб «Шкалы оценки симптомов острого цистита» (ACSS) в День 1 в сочетании с положительным тестом на лейко- цитарную эстеразу, свидетельствующем о лейкоцитурии.
- Появление симптомов цистита, отмечаемое пациента- ми в течение не более 6 дней до Дня 1.
- Подтверждение использования высокоэффективных методов контрацепции во время всего исследования, либо подтвержденная хирургическая стерильность, либо под- твержденный период постменопаузы.
Критерии невключения
- Рецидивирующая ИМП в анамнезе.
- Любые симптомы, указывающие на осложнённую ИМП, пиелонефрит и (или) вульвовагинит в День 1.
- Любые состояния, которые могли бы привести к осложнениям инфекции.
Рандомизация и маскировка данных
Методом случайного выбора пациентки распределялись в пропорции 1:1 в группу применения BNO 1045 и плацебо, имитирующего ФТ, или в группу применения ФТ и плацебо, имитирующего BNO 1045. Рандомизационная последовательность формировалась из блоков, определенных компьютером; номера участниц объединялись в блоки, при этом размер блока исследователям не сообщался. Задача подготовки и проверки рандомизационного списка выполнялась с помощью валидированной компьютеризированной системы. Результаты распределения в терапевтические группы не были известны ни пациенткам, ни исследователям.
Процедуры
За общее управление исследованием отвечала контрактная исследовательская организация; главный исследователь в каждом исследовательском центре отвечал за набор пациенток. В процессе получения информированного согласия пациенткам давали рекомендации по применению препаратов.
Пациентки в группе применения ФТ получали 5,631 г ФТ (эквивалентно 3 г фосфомицина) в виде гранул, которые нужно было растворить в 100–200 мл воды и сразу же принять внутрь. Препарат применялся в День 1 исследования, однократно, под непосредственным наблюдением врача. Пациентки в группе применения BNO 1045 получали покрытые оболочкой таблетки, содержащие 18 мг измельченного золототысячника (Centaurii herba), 18 мг корня любистка (Levistici radix) и 18 мг листьев розмарина (Rosmarini folium). Пациентки принимали по 2 таблетки BNO 1045 перорально 3 раза в день в течение 7 дней, до или после приема пищи. Измельченный растительный материал, использованный в исследуемом лекарственном средстве (ИЛС), был изготовлен в рам- ках одной производственной серии и получен из растений, выращиваемых и культивируемых в определенных контролируемых условиях, с соблюдением жестких стандартов качества.
Лечение начиналось в День 1 и продолжалось в течение 7 дней до Дня 8 (дополнительные материалы представлены на сайте, страница 2). Период последующего наблюдения составлял 30 дней после приема последней дозы препарата (до Дня 38); его целью было определить, возник ли рецидив нИМП. Исследователи заполняли соответствующие бланки для сбора данных.
Единственным разрешенным сопутствующим препаратом для симптоматического лечения был парацетамол.
График обследования каждого пациента приведен в таблице 1.
Таблица 1. Повизитное расписание процедур исследования
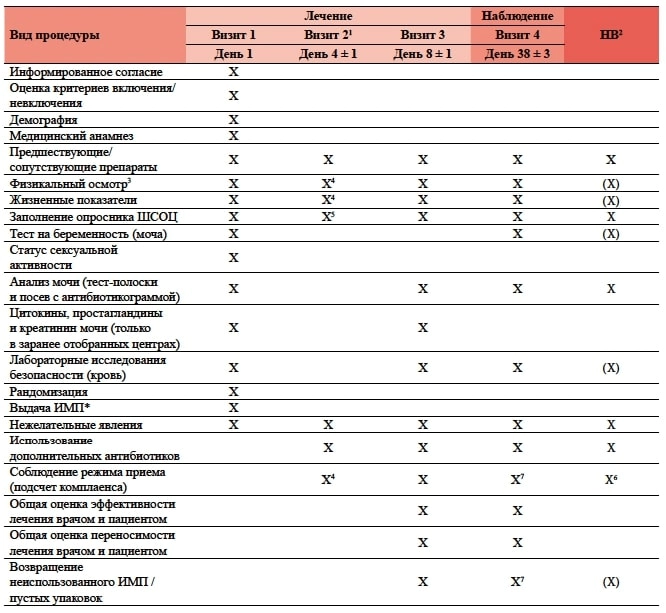
ШСОЦ — «Шкала оценки симптомов острого цистита»; ИМП — исследуемый медицинский препарат; НВ — незапланированный визит.
* Дата и время предшествующего приема пищи фиксировалась в карте пациента (фосфомицина трометамол принимался за 2 часа до или после приема пищи).
- Визит мог быть проведен в центре или по телефону.
- НВ мог быть выполнен в любое время между Визитом 1 и Визитом 4, если исследователь считал его проведение необходимым. Необязательные процедуры, которые могли быть проведены на усмотрение исследователя, указаны в скобках, (X).
- Стандартный физикальный осмотр проводился на Визите 1 и Визите 4; на других визитах мог быть проведен физикальный осмотр, направленный на выявление урологической симптоматики.
- Контроль соблюдения режима приема (подсчет комплаенса) проводился, только если Визит 2 проходил в центре.
- В случае телефонного визита опросник ШСОЦ заполнялся пациентом дома и сразу же высылался исследователю по почте.
- Подсчет комплаенса проводился, только если НВ проходил между Визитом 1 и Визитом 3.
- Только если весь выданный ИМП, включая упаковки, не был уже возвращен на Визите 3.
Конечные точки
Основной целью клинического исследования было продемонстрировать неменьшую эффективность препарата BNO 1045 при применении в течение 7 дней в сравнении с однократной дозой ФТ у женщин с острой нИНМП, определяемую по процентной доле пациенток, в ходе исследования дополнительно получавших АБ для лечения острой нИНМП.
Первичной конечной точкой эффективности был показатель применения АБ, определяемый как процентная доля пациенток, дополнительно получавших АБ для лечения острой инфекции нижних мочевыводящих путей в период между Днями 1 и 38 ± 3. Вторичные конечные точки эффективности включали в себя показатель шкалы ACSS по состоянию на Дни 4, 8 и 38, а также наличие бактериурии и лейкоцитурии, определяемое путем анализа посева мочи (средняя порция мочи) при каждом визите в исследовательский центр2.
Опросник ACSS представляет собой простую, стандартизированную, заполняемую пациенткой анкету для диагностики острого неосложненного цистита, в которой оцениваются типичные и дифференциальные симптомы, качество жизни (КЖ; англ. QoL — Quality of Life) и изменения после лечения 20,21. В данном клиническом исследовании использовались две версии анкеты: в День 1 заполнялась часть A для оценки состояния на исходном уровне, а на последующих визитах (Дни 4, 8 и 38) заполнялась часть B.
Часть A включала в себя 18 вопросов, в том числе 6 вопросов, касающихся типичных симптомов нИН- МП (шкала ACSS-typical), 4 вопроса относительно симптомов для дифференциального диагноза (ACSSdifferential), 3 вопроса по поводу качества жизни (ACSSQoL) и 5 вопросов о любых дополнительных условиях, которые могут повлиять на лечение (ACSS-additional). Ответы на вопросы оценивались по 4-балльной шкале Лайкерта (где 0 = симптомы отсутствуют, 1 = легкие симптомы, 2 = умеренные симптомы, 3 = тяжелые симптомы), кроме раздела ACSS-additional, где даются ответы «да/нет».
Часть B включала в себя все разделы части A, а также дополнительный раздел для оценки изменений симптомов ИМП на последующих визитах относительно Дня 1 по 5-балльной шкале, где 0 = все симптомы исчезли, 1 = большинство симптомов исчезли, 2 = некоторые симптомы остались, 3 = все симптомы остались, 4 = мое состояние ухудшается.
Все пациентки пользовались утвержденной версией ACSS на родном языке (немецкий, польский, украинский или русский; www.acss.world).
Конечные точки безопасности, оцениваемые в дан- ном исследовании, включали в себя нежелательные явления, возникшие в ходе лечения (НЯ), лабораторные показатели для оценки безопасности (анализ крови и мочи) в Дни 8 и 38, общую переносимость (по оценке исследователей и пациенток) по состоянию на Дни 8 и 38, физикальное обследование и определение основных физиологических показателей в Дни 1, 4, 8 и 38.
Количество и процентная доля пациенток, принимавших парацетамол в течение 24 часов до визита, регистрировались и анализировались с разбивкой по визитам и терапевтическим группам.
Объем выборки и методика анализа
В выборку пациенток без нарушений протокола (англ. PPS — Per Protocol Set) включались все пациентки из выборки для полного анализа (англ. FAS — Full Analysis Set), у которых не отмечалось серьезных отклонений от протокола. Первичный анализ проводился в выборке PPS. Объем выборки и статистическая мощность определялись с учетом следующих допущений и параметров дизайна исследования:
- показатель дополнительного применения антибиотиков в группе ФТ составляет менее 10 %;
- показатель дополнительного применения антибиотиков в группе BNO 1045 составляет менее 15 %;
- предел неменьшей эффективности — 15 %;
- уровень значимости при множественных сравнениях с применением 1-стороннего критерия (групповая вероятность ошибки) — 2,5 %;
- равномерное и сбалансированное распределение пациенток по исследовательским центрам, отсутствие зависимости результатов от различий между центрами, отсутствие зависимости применяемой терапии от исследовательского центра;
- не более 20 % пациенток с серьезными нарушения- ми протокола, данные которых не могут быть включены в первичный анализ в PP-выборке.
В выборку для анализа безопасности включались все пациентки, принявшие ИЛС хотя бы один раз. В выбор- ку FAS входили те же пациентки, что и в выборку для анализа безопасности, но исключались пациентки, данные которых могли быть демаскированы. При клинической необходимости врач мог в любое время запросить отчет о микробиологическом анализе; в таких случаях данные пациентки демаскировались.
Запланированный объем выборки составлял 322 рандомизированные пациентки в каждой терапевтической группе (258 пациенток в выборке PPS), что обеспечивало статистическую мощность минимум 90 % для демонстрации неменьшей эффективности BNO 1045 в сравнении с ФТ при возможном дополнительном применении АБ. Разницу определяли с помощью критерия Фэррингтона и Маннинга.
Статистический анализ
Основной целью исследования было изучить варианты, альтернативные антибиотикотерапии, для лечения острых нИНМП. В исследовании сравнивались 2 различных механизма действия: симптоматическое воздействие препарата BNO 1045 на организм и уничтожение бактерий с помощью ФТ. Таким образом, было целесообразно установить предел неменьшей эффективности, составляющий 15 %, вместо обычно применяемого предела в 10 %. Со- гласно руководствам Европейской ассоциации урологии (ЕАУ) 4, нИНМП считается неопасной инфекцией, следовательно, у пациенток, не применявших АБ, риск не увеличивался.
Критерий Фэррингтона и Маннинга применялся для расчета разницы в процентных долях и для оценки первичной конечной точки эффективности. Для определения неменьшей эффективности с применением 1-стороннего критерия был установлен уровень значимости α = 0,025. Рассчитывался 95%-й ДИ с применением 2-стороннего критерия. Этот критерий применялся также в выборке FAS для оценки робастности результатов в выборке PPS.
Разница между группами в показателях шкалы ACSS оценивалась с помощью критерия Уилкоксона — Манна — Уитни (для распределения тестируемых образцов) и с применением ДИ по методу Ходжеса — Лемана (для медианно-несмещенной оценки медианного значения в выборке). Количество бактерий определяли категориаль- но (количество колониеобразующих единиц [КОЕ] на 1 мл мочи < 103, 103, 104, 105, 106 или >106), сравнение между терапевтическими группами проводили с помощью критерия хи-квадрат. Сравнение между группами в отношении процентной доли пациенток, применявших парацетамол, также проводилось с помощью критерия хи-квадрат.
Статистический анализ в данном исследовании не предусматривал множественных проверок, поскольку все вторичные конечные точки анализировались с учетом того, что они носят поисковый характер.
Результаты
В период между 10 февраля 2016 года и 5 мая 2017 года в исследование были включены 668 пациенток. Из них 659 пациенток были рандомизированы: 325 — для применения BNO 1045 и плацебо, имитирующего ФТ, 334 — для применения ФТ и плацебо, имитирующего BNO 1045 (рис. 1). Девять пациенток не удовлетворяли всем критериям включения или имели хотя бы один критерий исключения, поэтому они не были рандомизированы и не получали исследуемый препарат.
Рис. 1. Распределение пациенток
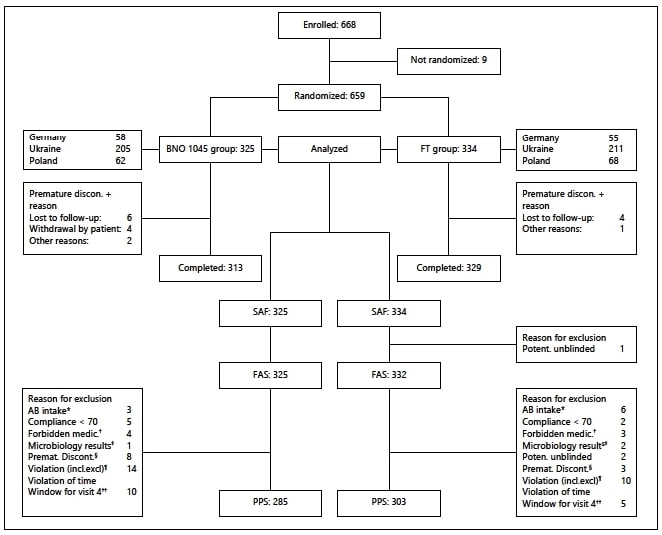
* Дополнительный прием АБ с возможным влиянием на течение нИМП. † Прием запрещенных исследованием препаратов. ‡ Запрос на получение результатов микробиологического анализа (возможная демаскировка данных). § Преждевременное прекращение участия в исследовании и отсутствие документации относительно приема АБ для лечения нИМП. ¶ Несоответствие критериям включения/невключения. †† Нарушение допустимого отклонения от за- планированной даты Визита 4.
АБ — антибиотик; FAS — выборка для полного анализа данных; ФТ — фосфомицина трометамол; PPS — выборка пациенток без нарушений протокола; SAF — выборка для анализа безопасности.
Enrolled — включены в исследование
Not randomized — не рандомизированы
Randomized — рандомизированы
Germany — Германия
Ukraine — Украина
Poland — Польша
BNO 1045 group — группа применения BNO 1045
FT group — группа применения ФТ
Analyzed — подлежат анализу
Premature discon. — преждевременно прекратили участие
Reason — причина
Lost to follow-up — потеряны для последующего наблюдения
Withdrawal by patient — отозвали согласие на участие
Other reasons — другие причины
Completed — завершили исследование
Reason for exclusion — причина исключения данных из анализа
Potent. unblinded — возможная демаскировка данных
AB intake — прием АБ
Compliance < 70 — комплаентность < 70
Forbidden medic. — применение препаратов, запрещенных протоколом
Microbiology results — результаты микробиологического анализа
Premat. Discont. — преждевременное прекращение участия
Violation (incl.excl) — несоответствие критериям включения/ невключения
Violation of time window for visit 4 — нарушение допустимого отклонения от запланированной даты Визита 4.
Таблица 2. Характеристики пациенток в выборке PPS по состоянию на День 1
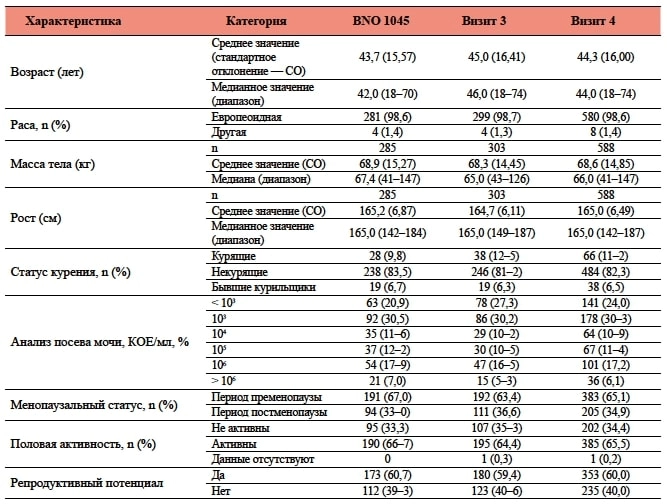
* (n = 302) для результатов анализа посева мочи.
† Сгруппированы в одну категорию с целью защиты данных.
ФТ — фосфомицина трометамол; N — количество пациенток в терапевтической группе; n — количество пациенток, данные которых подлежали анализу; % — процентная доля относительно N; PPS — выборка пациенток без нарушений протокола.
В таблице 1 приведены характеристики пациенток в выборке PPS по состоянию на День 1. Большинство пациенток принадлежали к европеоидной расе (98,6 %) и были некурящими (82,3 %). Средний возраст составлял 44,3 года, средняя масса тела — 68,6 кг, средний рост — 165,0 см. Большинство пациенток пребывали в периоде пременопаузы (65,1 %), имели репродуктивный потенциал (60,0 %) и были сексуально активны (65,5 %). Примерно у 25 % пациенток отмечались типичные симптомы острой нИНМП и пиурия (см. критерии включения), но в посевах мочи в День 1 содержалось менее 103 КОЕ/мл.
Большинство пациенток не принимали дополнительно АБ в период между Днями 1 и 38 (в группе BNO 1045: n = 238; 83,5 %; в группе ФТ: n = 272; 89,8 %; рис. 2). Рас- считанная разница между терапевтическими группами в выборке PPS не превышала предел неменьшей эффективности, составляющий 15 % (разница в показателе неприменения АБ составляла –6,26 %; 95%-й ДИ — от –11,99 до –0,53 %; p-значение при применении 2-стороннего критерия — 0,0014). Робастность результатов подтверждалась при анализе неменьшей эффективности BNO 1045 в сравнении с ФТ в выборке FAS (разница в показателе неприменения АБ составляла –8,25 %; 95%-й ДИ — от –13,82 до –2,68 %; p-значение при применении 2-стороннего критерия — 0,0088). При анализе чувствительности в выборке FAS не отмечалось существенного влияния отсутствующих данных в выборке PPS и подтверждалась статистическая значимость первичной конечной точки.
Рис. 2. Неменьшая эффективность BNO 1045 в сравнении с ФТ (показатель неприменения АБ) в выборке PPS.
Процентные значения означают процентную долю пациенток в соответствующей терапевтической группе, которые не принимали АБ в период между Днями 1 и 38±3. Планки погрешностей соответствуют 95 % ДИ. Сравнение показателей неприменения АБ в терапевтических группах проводилось с применением статистического критерия Фэррингтона и Маннинга, с 95 % доверительными интервалами и p-значениями при применении 2-стороннего критерия для определения разницы в показателях неприменения АБ ФТ — фосфомицина трометамол.
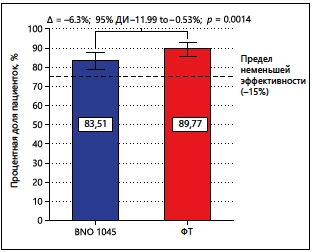
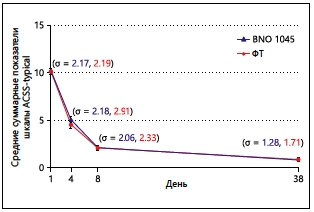
Рис. 3. Сравнение средних суммарных показателей шкалы ACSS-typical в период между Днями 1 и 38 ± 3 (в выборке FAS)
Точками ввода данных считаются средние суммарные показатели шкалы ACSS-typical для каждой терапевтической группы в каждый контрольный момент времени. Планки погрешностей соответствуют доверительным интервалам по Ходжесу и Лиману. Цифры в скобках означают стандартные отклонения (σ) суммарных показателей при применении BNO 1045 и ФТ, соответственно. ACSS — Шкала оценки симптомов острого цистита; FAS — выборка для полного анализа данных; ФТ — фосфомицина трометамол.
При последующем анализе чувствительности в выборке PPS применялась регрессионная логистическая модель, где за зависимую переменную принимали при- ем пациентками антибиотиков (да/нет), за ковариату — возраст, за факторы — препарат, половую активность и прием гормональных препаратов. Анализ не обнаружил влияния указанных факторов на первичную конечную точку (p > 0,05).
На протяжении клинического исследования показатели дополнительного приема АБ в группах были сравнимы независимо от причины (персистирование или ухудше- ние симптомов: BNO 1045 — 66,0 % и ФТ — 67,7 %; ре- цидивирующие симптомы: BNO 1045 — 23,4 % и ФТ — 25,8 %; отсутствие симптомов: BNO 1045 — 10,6 % и ФТ — 6,5 %).
Средние суммарные показатели шкалы ACSS-typical в выборке FAS по состоянию на День 1 были сравнимы- ми (BNO 1045 — 10,2; ФТ — 10,1) и существенно снизились к Дню 4 (BNO 1045 — 5,1; ФТ — 4,5), к моменту завершения лечения (BNO 1045 — 2,1; ФТ — 2,1) и к моменту завершения периода последующего наблюдения (BNO 1045 — 0,8; ФТ — 0,9; рис. 3). Сравнение средних суммарных показателей шкалы ACSS-typical по Ходжесу и Леману показало, что по состоянию на День 4 снижение было несколько более существенным в группе применения ФТ (p = 0,0166), но на момент завершения лечения и на момент завершения периода последующего наблюдения оно было сравнимым (p > 0,05).
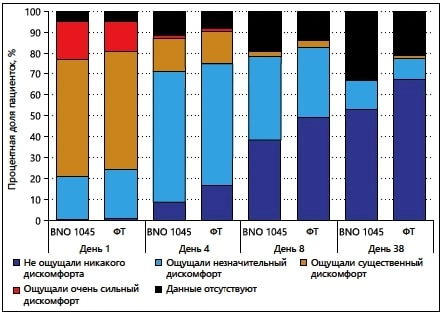
В целом, согласно результатам анализа показателей шкалы ACSS, при применении BNO 1045 наблюдалась тенденция к уменьшению тяжести симптомов нИНМП во временной динамике и к улучшению качества жизни по 4-балльной шкале Лайкерта. Эти результаты были сравнимы с уменьшением тяжести симптомов нИНМП и улучшением качества жизни, наблюдаемыми у пациенток, принимавших ФТ (рис. 4).
В обеих группах процентная доля пациенток без су- щественной бактериурии (< 103 КОЕ/мл) в выборке FAS увеличилась с Дня 1 до завершения лечения (BNO 1045 — с 25,5 % [n = 83] до 31,1 % [n = 101]; ФТ — с 21,4 % [n = 71] до 36,7 % [n = 122]). Отмечалась разница между группами в частоте развития бактериурии на момент завершения лечения в пользу применения ФТ (p = 0,028). По состоянию на День 8 было зарегистрировано уменьшение лейкоцитурии относительно Дня 1 примерно у трети пациенток в выборке FAS (BNO 1045 — со 100,0 % [n = 325] до 37,2 % [n = 121]; ФТ — со 100,0 % [n = 332] до 34,9 % [n = 116]). По состоянию на День 8 не было обнаружено существенной разницы между группами в частоте развития лейкоцитурии.
Более 95 % пациенток в обеих терапевтических группах (в выборке FAS) не принимали парацетамол в течение 24 часов до любого из визитов в рамках исследования, разницы между группами не наблюдалось (p > 0,05).
В целом в ходе клинического исследования у 92 пациенток (14,0 %) возникло хотя бы 1 нежелательное явление, возникшее в ходе лечения (НЯВЛ (Treatment-emergent AE)). Количество их было примерно одинаковым в обе- их группах (BNO 1045 — 49 пациенток [15,1 %]; ФТ — 43 пациентки [12,9 %]; таблица 2).
Наиболее частыми НЯВЛ были нарушения со стороны желудочно-кишечного тракта, частота которых была более высокой в группе применения ФТ (у 22 пациенток), чем в группе BNO 1045 (у 13 пациенток). В период исследования у 2 пациенток возникли три серьезных НЯВЛ: у 1 пациентки в группе ФТ — обострение хронического панкреатита и перелом шейки бедра, у 1 пациентки в группе BNO 1045 — пиелонефрит средней степени тяжести. По оценке исследователя, ни одно серьезное НЯВЛ не было связано с применением ИЛС.
Общая частота развития пиелонефрита была низкой; тем не менее в группе применения BNO 1045 пиелонефрит отмечался у большего количества пациенток (n = 5, в 4 случаях — легкой степени, в 1 случае — средней степени), чем в группе применения ФТ (n = 1, легкой степени). В группе применения BNO 1045 в трех из пяти случаев пиелонефрит был зарегистрирован в день включения в исследование (1 случай) или через 1 день после включения (2 случая). Это говорит о том, что по состоянию на День 1 пиелонефрит, возможно, уже развивался, но без очевидных диагностических признаков.
Ни одна пациентка не прекратила участие в исследо- вании из-за возникновения НЯВЛ и ни одна пациентка не умерла в период исследования.
Рис. 4. Шкала ACSS-QoL; дискомфорт, вызванный симптомами, за последние 24 часа (в выборке FAS)
ACSS-QoL — «Шкала оценки качества жизни, связанного с симптомами острого цистита»; FAS — выборка для полного анализа данных; ФТ — фосфомицина трометамол.
Комментарий
Данное клиническое исследование в масштабной популяции женщин с острой нИНМП демонстрирует не- меньшую эффективность растительного лекарственного препарата в сравнении с АБ для лечения острой нИНМП. Симптоматическое лечение препаратом BNO 1045 было не менее эффективным, чем АБ-терапия с применением ФТ, с точки зрения предотвращения дополнительного приема АБ для лечения острой нИНМП у женщин. Эти данные убедительно свидетельствуют в пользу замены АБ-терапии симптоматическим лечением препаратом BNO 1045 при нИНМП и проведения дальнейших исследований в области применения растительных препаратов, альтернативных антибиотикам, при нИНМП.
Современные практические руководства ЕАУ 4 рекомендуют применять АБ в качестве препаратов первой линии при лечении ИМП. Учитывая, что ИМП принадлежат к наиболее распространенным инфекционным заболеваниям в общей медицинской практике 1,2, эта рекомендация может в значительной степени способствовать углублению глобальной проблемы антибиотикорезистентности.
Таким образом, очень важно определить альтернативные стратегии. В предыдущих исследованиях было выдвинуто предположение, что можно значительно снизить потребление АБ путем первичного симптоматического лечения нИНМП с применением НСПВП 9,10, хотя лечение такими препаратами клинически менее эффективно, чем АБ-терапия. Тем не менее полученные результаты были достаточно убедительны, чтобы в немецких протоколах диагностики и лечения 22 появилась рекомендация применять симптоматическое лечение без антибиотиков в случаях острых нИНМП с симптомами легкой или средней степени тяжести.
Кроненберг (Kronenberg) и др. 10 предположили, что комбинированный подход, заключающийся в симптоматическом лечении с возможным отсроченным селективным применением АБ может существенно снизить общее потребление антибиотиков. Поскольку 83,5 % пациенток, принимавших BNO 1045, не нуждались в дополнительном приеме АБ для лечения нИНМП, применение этого альтернативного растительного препарата снизило потребность амбулаторных пациентов в антибиотиках для лечения нИНМП более чем на 80 % (рис. 2).
Таблица 3. НЯВЛ с распределением по классам систем органов согласно MedDRA* в выборке SAF** (частота возникновения — более чем у 1 пациентки в любой из терапевтических групп)
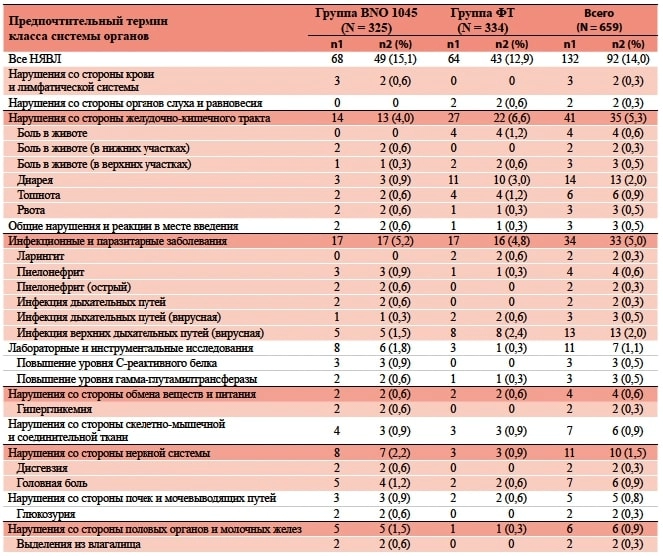
* MedDRA — Медицинский словарь регуляторной деятельности.
** SAF — выборка для анализа безопасности.
ФТ — фосфомицина трометамол; N — количество пациенток в терапевтической группе; n1 — количество нежелательных явлений; n2 — количество пациенток, у которых возникло хотя бы одно нежелательное явление; % — процентная доля пациенток с соответствующими НЯВЛ относительно N; НЯВЛ — нежелательное явление, возникшее в ходе лечения.
Результаты основной гипотезы, проверяемой в выбор- ке PPS, подтверждались анализом в выборке FAS — под- группе, в которой учитывались также условные результаты анализа при наихудшем варианте дополнительного приема АБ в период между Днями 1 и 38. Было установлено, что продемонстрированная при сравнении препаратов неменьшая эффективность не зависит от возраста пациенток, половой активности или приема гормональных лекарственных средств.
Клиническая польза обоих препаратов в уменьшении основных симптомов по шкале ACSS-typical наблюдалась после 3 дней лечения (на День 4), хотя у пациенток, принимавших ФТ, средний показатель уменьшения был более высоким, чем у тех, кто принимал BNO 1045 (p = 0,0166). Эти результаты сопоставимы с данными, полученными Кроненбергом и др. 10, согласно которым продолжительность разрешения симптомов была более высокой при применении НСПВП (4 дня), чем при АБ-терапии (2 дня). Тем не менее в данном клиническом исследовании наблюдалась четкая тенденция к существенному снижению тяжести симптомов нИНМП и улучшению качества жизни на момент завершения 7-дневного периода лечения. Это говорит о том, что общая эффективность BNO 1045 в этой популяции пациенток была сравнима с эффективностью ФТ.
Препарат BNO 1045 в целом хорошо переносился; не было выраженной разницы между группами применения BNO 1045 и ФТ в частоте возникновения нежелательных явлений или сигналов, связанных с безопасностью, за исключением того, что в группе BNO 1045 возникло меньше случаев нарушений со стороны желудочно-кишечного тракта (4,0 %), чем в группе ФТ (6,6 %), и в группе BNO 1045 отмечалось несколько больше случаев пиелонефрита (1,5 %) в сравнении с группой ФТ (0,3 %). Более высокая частота пиелонефрита не была неожиданностью, учитывая, что его изначальный риск в плацебо-контролируемых исследованиях нИНМП составляет 1–2 % 23,24. Более высокая частота развития пиелонефрита ранее отмечалась при применении ибупрофена (2,1 %) в сравнении с АБ (0,4 %) 8 и диклофенака (4,5 %) в сравнении с АБ (0,0 %) 10. Таким образом, можно заключить, что применение BNO 1045 в сравнении с АБ не представляет повышенного риска для пациентов, особенно с учетом того, что при появлении симптомов, указывающих на инфекцию верхних мочевыводящих путей, возникла бы необходимость в применении АБ-терапии. Тем не менее в последующих исследованиях необходимо получить дополнительные данные относительно частоты развития пиелонефрита при применении BNO 1045.
Данное исследование имело некоторые ограничения, в том числе отрицательные результаты посева мочи примерно у четверти пациенток. Это может объясняться двумя причинами. Во-первых, при пределе обнаружения, составляющем 103 КОЕ/мл, может быть не выявлена уропатогенная бактерия E. coli в малых количествах 25,26. Тем не менее включение в исследование пациенток с симптомами определенной степени тяжести может быть целесообразным, учитывая, что симптомы со стороны мочевыводящих путей и бактериурия часто возникают независимо друг от друга 27. Во-вторых, доставка образцов мочи в пробирках с боратным буфером из некоторых клинических центров в центральную лабораторию занимала более 24 часов, что могло повлиять на результаты 28. Кроме того, при оценке дополнительного приема АБ и соблюдения требований протокола относительно применения BNO 1045 исследователи полагались на сообщения пациенток. Наконец, необходимость дополнительного приема антибиотиков для пациенток, у которых ухудшались симптомы нИМП, определялась исследователем; в различных исследовательских центрах могли применяться разные критерии оценки такой необходимости.
В целом данное клиническое исследование в масштабной популяции пациенток подтверждает целесообразность симптоматического лечения острых нИНМП как альтернативы антибиотикотерапии. Была доказана неменьшая эффективность растительных препаратов в сравнении с антибиотиками. К тому же они вызывали меньше побочных реакций со стороны желудочно-кишечного тракта, таких как диарея и боль в животе. Наряду с результатами предыдущих исследований 8-10 данное исследование может увеличить массив данных относительно вариантов лечения и способствовать более широкому применению препаратов, альтернативных антибиотикам, таких как BNO 1045, для лечения нИНМП в повседневной клинической практике.
Благодарности
Данное клиническое исследование зарегистрировано на сайте clinicaltrials.gov под номером NCT02639520 и в реестре EudraCT под номером 2013-004529-99. Протокол исследования, формы информированного согласия и любые другие документы, связанные с исследованием, были проверены и утверждены независимым Комитетом по вопросам этики.
Спонсором клинического исследования выступала компания «Бионорика СЕ» (Германия), координатором — контрактная исследовательская организация Clinipace Worldwide (CPWW). Сотрудники компании «Бионорика СЕ» участвовали в разработке дизайна исследования, сборе, анализе и интерпретации данных. В написании медицинского текста помогала Джейми Турман-Ньюелл, доктор наук, представитель компании Synergy Vision (Великобритания), финансовую поддержку оказывала компания «Бионорика СЕ». Авторы, являющиеся сотрудниками компании «Бионорика СЕ», имели полный доступ к данным исследования. Все авторы проверили и утвердили окончательный вариант статьи.
Авторы выражают благодарность Джахонгиру Ф. Алиджанову за советы и ценный вклад как в проведение исследования, так и в написание статьи; Лютгарду Шпитцнагель-Шминке, Мирьям Риттмейер, Бенедикту Гранделю, Сабине Шарль, Биргит Бом и Бернарду Наушу — за помощь в медицинских и научных вопросах; Бьорну Вуллту — за рекомендации по научному обоснованию интерпретации результатов.
Авторы благодарят всех перечисленных ниже исследователей, участвовавших в клиническом исследовании: Адриан Пилатц, Торстен Брюнс, Стефан Ф. Регнер, Майке Бойке, Тим Шнайдер, Маттиас Шульце, Майкл Раг, Томас Бенуш, Кристел Концен, Лиана Висмейн, Мануэла Тинессе-Маллвитц, Тамара Экерманн, Инга Штайнебах, Андор Шмидт, Томаш Бличарский, Мацей Пашковский, Катажина Ланда, Эва Писарчик- Богацка, Рафаль Кмечак, Дорота Кнычас, Рената Внетшак- Михальска, Магдалена Яруховска, Дмитрий Соломчак, Татьяна Костыненко, Владимир Кошля, Виктор Стус, Алексей Люлько, Александр Шуляк, Павел Чабанов, Игорь Антонян, Ирина Дудар, Владимир Угаров, Олег Лесняк, Петр Иващенко, Лилия Мартынюк, Игорь Криворотко, Наталья Коломийчук.
Авторы также выражают благодарность всем остальным исследователям, членам исследовательских коллективов и пациенткам, принимавшим участие в исследовании.
Заявление о раскрытии информации
Спонсором клинического исследования выступала компания «Бионорика СЕ» (Германия), координатором — контрактная исследовательская организация Clinipace Worldwide (CPWW). Сотрудники компании «Бионорика СЕ» участвовали в разработке дизайна исследования, анализе и интерпретации данных. Профессор Вагенленер отвечал за сбор, проверку и перепроверку данных. Ответственный автор имел полный доступ ко всем данным исследования и принимал окончательное решение о предоставлении статьи для публикации.
Вклад авторов
Все авторы заполнили стандартную форму раскрытия информации на сайте Международного комитета редакторов медицинских журналов (ICMJE) www.icmje.org/ coi_disclosure.pdf, где заявили о том, что финансирование и помощь в проведении исследования оказывала компания «Бионорика СЕ». Флориан М. Вагенленер заявляет о получении гонораров за персональные консультации и другие услуги от компании «Бионорика СЕ» в период проведения исследования, о получении персональных гонораров, не относящихся к данной статье, от компаний Achaogen, AstraZeneca, Janssen, LeoPharma, MerLion, MSD, OM Pharma / Vifor Pharma, Pfizer, RosenPharma и VenatoRx; а также о других выплатах, не относящихся к данной статье, от компаний Enteris BioPharma, Helperby Therapeutics и Shionogi. Курт Г. Набер заявляет о получении гонораров за персональные консультации и другие услуги от компании «Бионорика СЕ» в период проведения исследования, а также о получении персональных гонораров, не относящихся к данной статье, от компаний Adamed, Apogepha, Daiich-Sankyo, Enteris, GSK, Helperby, Hermes, Medice, MerLion, OM Pharma / Vifor, Paratek, Roche, Saxonia и Zambon. Дмитрий Абрамов-Соммарива, Губерт Штайндль и Мартина Гёллер являются сотрудниками компании «Бионорика СЕ».
Библиографические ссылки
- Wagenlehner F.M., Weidner W., Naber K.G. An update on uncomplicated urinary tract infections in women. Curr Opin Urol. 2009. V. 19. P. 368–374.
- Foxman B. The epidemiology of urinary tract infection. Nat Rev Urol. 2010. V. 7. P. 653–660.
- Loew D., Dieter D., Habs M., Klimm H.D., Trunzler G. Erkrankungen der ableitenden Harnwege // Loew D., Habs M., Klimm H.-D., Trunzler G. eds. Phytopharmaka-Report: Rationale Therapie mit pflanzlichen Arzneimitteln. Heidelberg: Steinkopff-Verlag Heidelberg, 2013.
- EAU Guidelines. Edn. presented at the EAU Annual Congress Copenhagen 2018. ISBN 978-94-92671-01-1. www.http://uroweb.org/ guideline/urological-infections.
- Langdon A., Crook N., Dantas G. The effects of antibiotics on the microbiome throughout development and alternative approaches for therapeutic modulation. Genome Med. 2016. V. 8. P. 39.
- Ventola C.L. The antibiotic resistance crisis: part 1: causes and threats. Pharm Ther. 2015. V. 40. P. 277–283.
- Tandogdu Z., Cek M., Wagenlehner F., Naber K., Tenke P., van Ostrum E., Johansen T.B. Resistance patterns of nosocomial urinary tract infections in urology departments: 8-year results of the global prevalence of infections in urology study. World J Urol. 2014. V. 32. P. 791–801.
- Bleidorn J., Hummers-Pradier E., Schmiemann G., Wiese B., Gagyor I. Recurrent urinary tract infections and complications after symptomatic versus antibiotic treatment: follow-up of a randomised controlled trial. Ger Med Sci. 2016. V. 14. Doc01.
- Gagyor I., Bleidorn J., Kochen M.M., Schmiemann G., Wegscheider K., Hummers- Pradier E. Ibuprofen versus fosfomycin for uncomplicated urinary tract infection in women: randomised controlled trial. BMJ. 2015. V. 351. h6544.
- Kronenberg A., Butikofer L., Odutayo A., Muhlemann K., da Costa B.R., Battaglia M., Meli D.N., Frey P., Limacher A., Reichenbach S., Juni P. Symptomatic treatment of uncomplicated lower urinary tract infections in the ambulatory setting: randomised, double blind trial. BMJ. 2017. V. 359. j4784.
- Stange R., Schneider B., Albrecht U., Mueller V., Schnitker J., Michalsen A. Results of a randomized, prospective, double-dummy, double- blind trial to compare efficacy and safety of a herbal combination containing Tropaeoli majoris herba and Armoraciae rusticanae radix with co-trimoxazole in patients with acute and uncomplicated cystitis. Res Rep Urol. 2017. V. 9. P. 43–50.
- Künstle G., Brenneis C., Haunschild J. Efficacy of Canephron® N against bacterial adhesion, inflammation and bladder hyperactivity. Eur Urol. 2013. V. 12. e671.
- Künstle G., Brenneis C., Pergola C., Werz O., Haunschild J. Anti-inflammatory effects of Canephron® N and effectiveness in a model of interstitial cystitis. Urologe. 2013. V. 52. (suppl 1). e97.
- Brenneis C., Künstle G., Haunschild J. Spasmolytic Activity of Canephron® N on the Contractility of Rate and Human Isolated Urinary Bladder: 13th International Congress of the Society for Ethnopharmacology. 2nd to 6th September 2012. Graz, Austria.
- Nausch B., Koeberle A., Werz O., Ammendola A., Künstle G. 262 Canephron® N reduces pain in experimental cystitis and prostatitis putatively by inhibition of PGE2 production. European Urology Supplements. 2016. V. 15. e262.
- Haloui M., Louedec L., Michel J.B., Lyoussi B. Experimental diuretic effects of Rosmarinus officinalis and Centaurium erythraea. J Ethnopharmacol. 2000. V. 71. P. 465–472.
- Naber K.G., Kogan M., Wagenlehner F.M.E., Siener R., Gessner A. How the microbiome is influenced by the therapy of urological diseases: standard versus alternative approaches. Clinical Phytoscience. 2017. V. 3. P. 8.
- Wullt B., Svanborg C. Deliberate establishment of asymptomatic bacteriuria — a novel strategy to prevent recurrent UTI. Pathogens. 2016. V. 5. P. 52.
- Naber K., Steindl H., Abramov-Sommariva D., Eskoetter H. Non-antibiotic herbal therapy of uncomplicated lower urinary tract infection in women — a pilot study. Planta Med. 2013. V. 79. PB1.
- Alidjanov J.F., Abduffattaev U.A., Makhsudov S.A., Pilatz A., Akilov F.A., Naber K.G., Wagenlehner F.M. New self-reporting questionnaire to assess urinary tract infections and differential diagnosis: acute cystitis symptom score. Urol Int. 2013. V. 92. P. 230–236.
- Alidjanov J.F., Abdufattaev U.A., Makhsudov S.A., Pilatz A., Akilov F.A., Naber K.G., Wagenlehner F.M.E. The acute cystitis symptom score for patient-reported outcome assessment. Urol Int. 2016. V. 97. P. 402–409.
- Kranz J., Schmidt S., Lebert C., Schneidewind L., Mandraka F., Kunze M., Helbig S., Vahlensieck W., Naber K., Schmiemann G., Wagenlehner F.M. The 2017 update of the German clinical guideline on epidemiology, diagnostics, therapy, prevention, and management of uncomplicated urinary tract infections in adult patients. Part II: therapy and prevention. Urol Int. 2018. V. 100. P. 263–270.
- Christiaens T.C., De Meyere M., Verschraegen G., Peersman W., Heytens S., De Maeseneer J.M. Randomised controlled trial of nitrofurantoin versus placebo in the treatment of uncomplicated urinary tract infection in adult women. Br J Gen Pract. 2002. V. 52. P. 729–734.
- Ferry S.A., Holm S.E., Stenlund H., Lundholm R., Monsen T.J. The natural course of uncomplicated lower urinary tract infection in women illustrated by a randomized placebo controlled study. Scand J Infect Dis. 2004. V. 36. P. 296–301.
- Stamm W.E., Counts G.W., Running K.R., Fihn S., Turck M., Holmes K.K. Diagnosis of coliform infection in acutely dysuric women. N Engl J Med. 1982. V. 307. P. 463–468.
- Hooton T.M., Roberts P.L., Cox M.E., Stapleton A.E. Voided midstream urine culture and acute cystitis in premenopausal women. N Engl J Med. 2013. V. 369. P. 1883–1891.
- Ferry S.A., Holm S.E., Stenlund H., Lundholm R., Monsen T.J. Clinical and bacteriological outcome of different doses and duration of pivmecillinam compared with placebo therapy of uncomplicated lower urinary tract infection in women: the LUTIW project. Scand J Prim Health Care. 2007. V. 25. P. 49–57.
- LaRocco M.T., Franek J., Leibach E.K., Weissfeld A.S., Kraft C.S., Sautter R.L., Baselski V., Rodahl D., Peterson E.J., Cornish N.E. Effectiveness of preanalytic practices on contamination and diagnostic accuracy of urine cultures: a laboratory medicine best practices systematic review and meta-analysis. Clin Microbiol Rev. 2016. V. 29. P. 105–147.
