
Лікування інфекцій сечовивідних шляхів препаратом Канефрон® у Німеччині: ретроспективний аналіз бази даних
Martina Höller1 , Hubert Steindl1, Dimitri Abramov-Sommariva1, Florian Wagenlehner2 , Kurt G. Naber3 та Karel Kostev4,*
- Компанія «Біонорика СЕ», Кершенштайнерштрассе 11–15, 92318 Ноймаркт, Німеччина (Kerschensteinerstrasse 11 – 15, 92318 Neumarkt, Germany); Martina.Hoeller@bionorica.de (M.H.); Hubert. Steindl@bionorica.de (H.S.); Dimitri.Abramov-Sommariva@bionorica.de (D.A.-S.)
- Клініка урології, дитячої урології та андрології, Гіссенський університет ім. Юстуса-Лібіха, Ру-дольф-Бухгайм-Штрассе 7, 35392 м. Гіссен, Німеччина (Rudolf-Buchheim-Straße 7, 35392 Giessen, Germany); wagenlehner@aol.com
- Кафедра урології, Мюнхенський технічний університет, PA: Карл-Бікледер-Штрассе 44c, 94315 м. Штраубінг, Німеччина (Karl-Bickleder Street 44c, 94315 Straubing, Germany); kurt@nabers.de
- Відділ епідеміології компанії «IQVIA», Унтершвайнстиге 2-14, 60549, м. Франкфурт-на-Майні, Німеччина (Unterschweinstiege 2-14, 60549 IQVIA, Frankfurt Am Main, Germany)
* Адреса для листування: karel.kostev@iqvia.com
Анотація:
Мета: Метою даного дослідження було провести оцінку лікування препаратом Канефрон® після встановлення діагнозу гострого циститу або інфекції сечовивідних шляхів (ІСШ) стосовно ризику спорадичних рецидивних ІСШ, частих рецидивних ІСШ; тривалості тимчасової непрацездатності, зумовленої ІСШ; додаткового призначення антибіотиків та ускладнень з боку нирок (пієлонефриту) порівняно зі стандартною антибіотикотерапією.
Методи: Це ретроспективне когортне дослідження ґрунтувалося на інформації з бази даних «Аналізатор захворювань IMS®» (IMS® Disease Analyzer, власність компанії «IQVIA»). До аналізу було включено амбулаторних пацієнтів у Німеччині, яким принаймні один раз було поставлено діагноз гострого циститу або ІСШ та призначено Канефрон® або стандартну антибіотикотерапію в період з січня 2016 р. по червень 2019 р. лікарем загальної практики (ЛЗП), гінекологом або урологом, та у яких було одержано відповідні дані. Для вивчення взаємозв’язків між призначенням препарату Канефрон® та кількістю спорадичних або частих рецидивних ІСШ, а також тривалістю тимчасової непрацездатності, зумовленої ІСШ, кількістю додаткових призначень антибіотиків та кількістю випадків пієлонефриту використовувалися моделі багатопараметричної регресії. Для ефектів препарату Канефрон® було використано поправку на вік, стать, страховий статус та індекс коморбідності Чарльсона (Charlson Comorbidity Score, ІКЧ). Результати: Для проведення аналізу були доступні дані щодо 2320 пацієнтів, які одержували Канефрон® та 158 592 пацієнтів, які одержували антибіотики. Порівняно з призначенням антибіотиків, призначення Канефрону® було значуще пов’язаним із зменшенням частоти спорадичних рецидивів ІСШ протягом 30–365 днів після індексної дати (співвідношення шансів (СШ): 0,66; 95%, довірчий інтервал (ДІ): 0,58‒0,72), а також із зменшенням частоти рецидивів ІСШ (СШ: 0,61; 95 % ДІ: 0,49‒0,88), та із невеликою частотою додаткового призначення антибіотиків протягом 31–365 днів (СШ: 0,57; 95 % ДІ: 0,52‒0,63). Між когортами пацієнтів, що одержували Канефрон® та антибіотикотерапію, не спостерігалось значущих відмінностей стосовно ймовірності того, що пацієнт візьме лікарняний (СШ: 0,99; 95 % ДІ: 0,86‒1,14), ймовірності нового призначення антибіотиків протягом 1–30 днів (СШ: 1,01; 95 % ДІ: 0,87‒1,16) та частоти виникнення пієлонефриту (співвідношення шансів (СШ): 1,00; 95 % ДІ: 0,67‒1,48).
Висновок: Наведені вище дані з реальної практики вказують на те, що Канефрон® — ефективний та безпечний засіб симптоматичної терапії гострого циститу або ІСШ. Його варто розглядати в якості альтернативного засобу лікування; зокрема, зважаючи на необхідність ширшого впровадження стратегії раціонального використання протимікробних препаратів.
Ключові слова:
- Канефрон;
- антибіотики;
- інфекції сечовивідних шляхів;
- когортне дослідження;
- фітотерапія.
1. Вступ
В усьому світі інфекції сечовивідних шляхів (ІСШ) уражають близько 150 мільйонів людей щороку 1 та є однією з провідних причин звернення дорослого населення за первинною медичною допомогою 2. За даними Foxman, майже в половини усіх жінок протягом життя виникає принаймні один епізод циститу, а близько третина жінок має принаймні один епізод циститу до 24-річного віку 3. У більшості випадків ІСШ — це гострий неускладнений цистит 4, а чинні настанови в якості терапії першої лінії рекомендують застосовувати антибіотики 5,6.
В якості відповіді на стрімке зростання кількості резистентних штамів бактерій, принципи раціонального використання антибіотиків закликають обачно застосувати антибіотики там, де це необхідно, та утримуватись від застосування антибіотиків, якщо це можливо. У більшості випадків неускладнених інфекцій імунна система організму спроможна впоратися з патогенними бактеріями; таким чином, антибіотики не є беззастережно показаними 7. Відповідно, «Настанови ЕС щодо обачного застосування протимікробних препаратів у медицині» (2017) на загал рекомендують лікарям уникати призначення антибактеріальних препаратів, коли наявні дані свідчать про наявність лише вірусної інфекції або самообмежувальної бактерійної інфекції. Виходячи з цієї потреби (уникати призначення антибіотиків там, де це можливо), засоби симптоматичної терапії, що не є антибіотиками, зайняли важливе місце у лікуванні пацієнтів з неускладненими ІСШ. До цього часу у дослідженнях проводилося порівняння ефективності нестероїдних протизапальних препаратів (НПЗП), наприклад, ібупрофену 8,9 або диклофенаку 10 та антибіотиків. Оскільки дані цих досліджень вказують на достатньо високу ефективність такого лікування, на сьогоднішній день декілька настанов також рекомендують призначати засоби, що не є антибіотиками. Відповідно до чинних настанов Європейської асоціації урологів (EAU) 5, а також німецьких міждисциплінарних настанов AWMF S3 6, антибіотики все ще вважаються варіантом терапії першої лінії при ІСШ, але у випадках гострого неускладненого циститу із легко або помірно вираженими симптомами слід розглянути можливість призначення засобів симптоматичної терапії, що не є антибіотиками. Призначення лікарських засобів рослинного походження також вважається належним підходом до лікування ІСШ «без антибіотиків» 11,12. Одним з таких засобів, що затверджений для використання у 31 країні, є Канефрон®, до складу якого входять трава золототисячнику (Centaurium erythraea Rafn, herba), корінь любистку (Levisticum officinale Koch, radix) та листя розмарину (Rosmarinus officinalis Linné, folium) 13. Канефрон® виявляє так звані «багатоцільові» властивості, у тому числі чинить спазмолітичну 14, сечогінну 15, антиоксидантну 16, антиадгезивну 17, протизапальну та знеболювальну 18 дію.
Ефективність Канефрону® було продемонстровано у цілій низці клінічних досліджень 13,19-21.
Нещодавно Wagenlehner et al. у рандомізованому подвійно сліпому дослідженні фази III показали, що ефективність Канефрону® при лікуванні гострих нІСШ у нижніх відділах сечовивідних шляхів у жінок не поступається антибіотикотерапії (фосфоміцину трометамол) за показником «попередження додаткового застосування антибіотиків для терапії з приводу цього показання» 21.
На думку Haynes, оцінювання співвідношення «користь–ризик» для лікарських засобів повинно проводитись не лише в умовах дослідження (тобто відповідати на питання «чи здатен цей препарат «працювати»?»), але й підтверджуватись в реальних умовах («чи «працює» цей препарат?», «чи варто його застосовувати?») 22. Через це метою даного дослідження було довести, базуючись на даних з реальної клінічної практики, ефективність монотерапії препаратом Канефрон® в якості засобу симптоматичної терапії ІСШ за звичайних умов клінічної практики та підтвердити таким чином клінічні дані, одержані у раніше проведених інтервенційних дослідженнях. Таким чином, ми провели оцінку частоти призначень Канефрону® (у вигляді препарату Канефрон® Н або препарату Канефрон® УНО) в якості лікування після встановлення діагнозу гострого циститу або ІСШ, а також потреби в додатковому призначенні антибіотиків у порівнянні зі стандартною антибіотикотерапією. Оскільки ризик рецидиву захворювання, його ускладнень, а також тривалість захворювання є частими причинами призначення антибіотиків, ми також дослідили вплив монотерапії препаратом Канефрон® на спорадичні та часті рецидивні ІСШ, пієлонефрит та тривалість тимчасової непрацездатності, зумовленої ІСШ.
2. Матеріали та методи
2.1. Джерела даних
Цей аналіз ґрунтувався на інформації з бази даних «Аналізатор захворювань IMS®», у якій містяться відомості щодо клінічних випадків, надані лікарями амбулаторій (як лікарями загальної практики ЛЗП, так і лікарями-спеціалістами) у Німеччині. У цій базі даних міститься інформація щодо демографічних даних пацієнтів, призначень лікарських препаратів, супутніх лікарських засобів, супутніх захворювань, тимчасової непрацездатності та скерувань до стаціонарних медичних закладів. Під час проведення аналізу даних нами враховувалися дані лише з тих медичних закладів, які раніше регулярно надсилали відомості до експертної групи IMS®DA. IMS®DA містить дані щодо більш ніж 10 мільйонів пацієнтів, внесені в проміжку між 2015 та 2019 роками.
Інформацію надають близько 3000 лікарів амбулаторій, що представляють близько 3 % усіх амбулаторій та приватних практик у Німеччині. Вибірка амбулаторій/приватних практик, включена у дослідження, є географічно репрезентативною для Німеччини та охоплює вісім основних регіонів країни. Застосовані у Німеччині методи формування вибірки для відбору амбулаторій/приватних практик лікарів є належними та забезпечують одержання репрезентативної бази даних амбулаторій загальної практики та спеціалізованих амбулаторій 23.
Законодавство Німеччини за певних умов дозволяє використання з дослідницькою метою анонімних даних електронної медичної документації. Згідно з цим законодавством, для проведення такого типу обсерваційного дослідження, що не передбачає використання даних, які могли б безпосереднім чином ідентифікувати пацієнта, немає необхідності одержувати інформовану згоду від пацієнтів чи дозвіл відповідної експертної ради закладу охорони здоров’я (ЕРЗ). Оскільки дані щодо пацієнтів запитувалися лише у сукупному вигляді та у відповідь на такі запити не надавалося жодної конфіденційної медичної інформації, для користування цією базою даних та для проведення даного дослідження не вимагалося жодних дозволів від ЕРЗ.
2.2. Вибірка дослідження та ко-змінні
До цього ретроспективного когортного дослідження включено пацієнтів з принаймні одним діагнозом гострого циститу (МКХ-10: N30.0) або ІСШ (МКХ-10: N39.0), встановленим в період між 01 січня 2016 р. та 30 червня 2019 р. у одній з амбулаторій ЛЗП, гінеколога або уролога, з яких було одержано дані. Дата першого діагнозу, задокументованого протягом цього періоду, вважалася індексною датою. До інших критеріїв включення відносилося принаймні 12 місяців спостереження перед встановленням цього діагнозу, що підтверджувалося записом про принаймні один візит до лікаря протягом періоду у ≥365 днів до індексної дати, а також призначення Канефрону® Н чи Канефрону® УНО або стандартного антибіотику (код ATX: J01) у індексну дату. Пацієнти, яким було призначено антибіотик протягом 30 днів до індексної дати; пацієнти, яким призначалися інші фітопрепарати протягом періоду дослідження, та пацієнти, яким у індексну дату було призначено Канефрон® разом з будь-яким антибіотиком, не допускалися до участі у дослідженні. Пацієнтів було розподілено на дві когорти: когорта препарату Канефрон® та когорта антибіотикотерапії; обидві когорти згодом порівнювалися одна з одною.
До ко-змінних, які використовувалися в даному дослідженні, відносилися вік, стать, покриття медичним страхуванням (приватним або обов’язковим загальнодержавним), спеціальність лікаря (ЛЗП, гінеколог, уролог) та індекс коморбідності Чарльсона (ІКЧ). ІКЧ — це метод категоризації наявних у пацієнта супутніх захворювань, що ґрунтується на Міжнародній класифікації хвороб (МКХ) та містить 19 категорій. Чим вище бал, тим з більшою ймовірністю передбачений результат призведе до смерті чи до більш інтенсивного використання ресурсів охорони здоров’я 24.
2.3. Статистичні аналізи
Визначалися відмінності щодо частки пацієнтів: (1) із спорадичними рецидивами ІСШ, що визначалися як наявність принаймні одного наново підтвердженого діагнозу ІСШ (МКХ-10: N39.0) або гострого циститу (МКХ-10: N30.0) протягом 30–365 днів з моменту встановлення первинного діагнозу; (2) із частими рецидивними ІСШ, що визначаються за керівними настановами EAU 5 як принаймні три діагнози інфекцій сечовивідних шляхів протягом 2–365 днів з моменту встановлення первинного діагнозу або принаймні два діагнози інфекції сечовивідних шляхів протягом 2–184 днів з моменту встановлення первинного діагнозу; (3) із тимчасовою непрацездатністю, зумовленою ІСШ, що визначається як документально підтверджена тимчасова непрацездатність протягом одного місяця після встановлення діагнозу ІСШ; (4) яким принаймні один раз було призначено антибіотики протягом 1–30 днів після встановлення діагнозу або пізніше (30–365 днів); та (5) із наявністю початкового документально підтвердженого діагнозу пієлонефриту (МКХ-10: N10-12) протягом терміну тривалістю до 3 років після встановлення діагнозу ІСШ.
Для вивчення взаємозв’язків між призначенням Канефрону® та зменшенням ризику спорадичних рецидивів ІСШ або частих рецидивних ІСШ, тривалістю тимчасової непрацездатності, зумовленої ІСШ, та призначенням антибіотиків, використовувалися моделі багатопараметричної логістичної регресії. Для ефектів препарату Канефрон® було використано поправку на вік, стать, страховий статус та ІКЧ. Моделі багатопараметричної регресії також будувалися окремо для осіб чоловічої та жіночої статі та для трьох вікових груп (≤40, 41–60, >60 років). Критерієм статистичної значущості вважалося р-значення < 0,05.
Розрахунок відмінностей між когортою препарату Канефрон® та когортою антибіотикотерапії щодо процентних часток пацієнтів, у яких було початково задокументовано виникнення пієлонефриту протягом терміну тривалістю до 3 років після встановлення діагнозу ІСШ, проводився за методом Каплана–Мейєра. Дані щодо пацієнтів із задокументованим діагнозом пієлонефриту, що виник до індексної дати, було вилучено з даного аналізу. Для вивчення взаємозв’язку між призначенням Канефрону® та ймовірністю виникнення пієлонефриту (з поправкою на вік, стать, страховий статус та ІКЧ) використовувалася модель багатопараметричної регресії Кокса.
3. Результати
3.1. Відбір пацієнтів та характеристики на вихідному рівні у пацієнтів, що взяли участь у дослідженні
З 232875 пацієнтів, яким було встановлено діагноз ІСШ (МКХ-10: N39.0) або гостро- го циститу (МКХ 10: N30.0), та які спостерігалися протягом щонайменше 365 днів до індексної дати, у день встановлення діагнозу Канефрон® Н або Канефрон® УНО було призначено 3343 (1,40%) пацієнтам, а антибіотики — 160 082 (68,74 %) пацієнтам. Після виключення пацієнтів, у яких Канефрон® поєднувався з антибіотиками, та пацієнтів, що отримували інші фітопрепарати для лікування ІСШ, а також після виключення пацієнтів, що приймали інші препарати для лікування ІСШ (наприклад, препарати, що містять маннозу, метіонін або арбутин) з когорти Канефрону®, на загал були доступні для аналізу дані щодо 2320 пацієнтів, які отримували Канефрон®, та 158 592 пацієнтів, що отримували антибіотики (Рисунок 1).
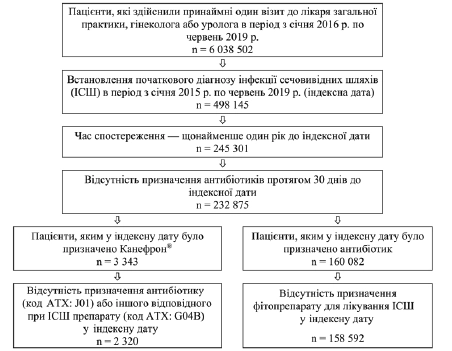
Рисунок 1. Відбір пацієнтів для участі у дослідженні.
З 69450 пацієнтів, не включених до аналізу через те, що їм у індексну дату не було призначено ані Канефрон®, ані антибіотик, у 93% не було призначено жодного препарату з приводу ІСШ або гострого циститу. При цьому лише 7% отримали якесь призначення (3 % — анальгетик, 3 % — препарати, що містять арбутин, та менше 1 % — інші препарати).
На загал у 4 % пацієнтів в когорті Канефрону® було паралельно призначено анальгетик, у той час як в когорті антибіотикотерапії ~3 % пацієнтів отримували анальгетики і лише у 1 % було призначено інші препарати (наприклад, препарати, що містять маннозу, метіонін або арбутин).
У таблиці 1 наведено характеристики пацієнтів, що взяли участь у дослідженні, на вихідному рівні. Пацієнти, що приймали Канефрон,® були значуще молодшими (51,3 (СВ: 19,9) у порівнянні з 55,0 (СВ: 20,8) років) та мали дещо нижчий індекс коморбідності (1,6 у порівнянні з 1,7), ніж пацієнти, яким було призначено антибіотики. Відсоткова частка пацієнтів жіночої статі (81,2 % у порівнянні з 90,8 %) була значуще нижчою, а відсоткова частка пацієнтів з приватною медичною страховкою (11,3 % у порівнянні з 7,6 %) була значуще вищою серед пацієнтів, що отримували Канефрон®, ніж серед пацієнтів в когорті антибіотикотерапії. Більшість пацієнтів в обох когортах лікувалися у ЛЗП (90,0 % у порівнянні з 80,7 %). Наявні відмінності щодо характеристик на вихідному рівні вказували на необхідність проведення аналізів зі стратифікацією за показниками «вік» та «стать».
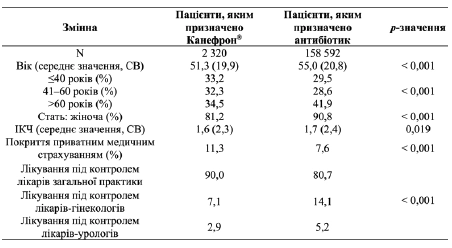
Таблиця 1. Основні характеристики пацієнтів, що брали участь у дослідженні
3.2. Спорадичні рецидивні інфекції сечовивідних шляхів
Протягом 30–365 днів після індексної дати у 12,3 % пацієнтів, яким було призначено Канефрон®, та у 17,2 % пацієнтів, яким було призначено антибіотики, було задокументовано принаймні один наново підтверджений діагноз ІСШ. Призначення Канефрону® асоціювалося зі значуще нижчими шансами на принаймні один наново підтверджений діагноз ІСШ протягом 30–365 днів після індексної дати (співвідношення шансів (СШ): 0,66; 95% довірчий інтервал (ДІ): 0,58‒0,72; p < 0,001). Цей взаємозв’язок спостерігався у осіб чоловічої та жіночої статі, а також у різних вікових групах (рисунок 2).
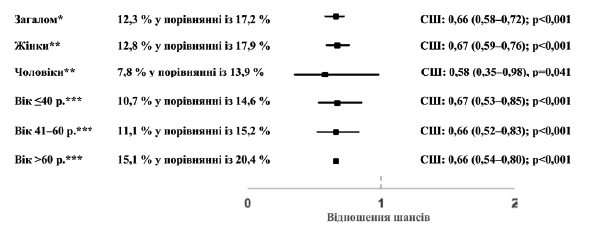
Рисунок 2. Взаємозв’язок між призначенням Канефрону® та наявністю нового підтвердженого діагнозу спорадичної ІСШ протягом 30–365 днів після індексної дати (Канефрон® у порівнянні з антибіотиком). *Багатопараметрична логістична регресія з поправкою на вік та стать пацієнта, покриття медичним страхуванням, спеціальність лікаря амбулаторії та ІКЧ. ** Багатопараметрична логістична регресія з поправкою на вік пацієнта, покриття медичним страхуванням, спеціальність лікаря амбулаторії та ІКЧ. ***Багатопараметрична логістична регресія з поправкою на стать пацієнта, покриття медичним страхуванням, спеціальність лікаря амбулаторії та ІКЧ.
3.3. Часті рецидивні інфекції сечовивідних шляхів
Наявність принаймні трьох діагнозів ІСШ, встановлених протягом 2–365 днів з моменту встановлення первинного діагнозу, або наявність принаймні двох діагнозів ІСШ, встановлених протягом 2–184 днів з моменту встановлення первинного діагнозу, було задокументовано у 3,1 % пацієнтів, яким було призначено Канефрон®, та у 5,0 % пацієнтів, яким було призначено антибіотики. Призначення Канефрону® асоціювалося зі значуще нижчими шансами появи частих рецидивних ІСШ (СШ: 0,601; 95 % ДІ: 0,49–0,88; p < 0,001). Цей взаємозв’язок (значущий чи у вигляді тенденції) спостерігався у осіб чоловічої та жіночої статі та у всіх вікових групах (рисунок 3).
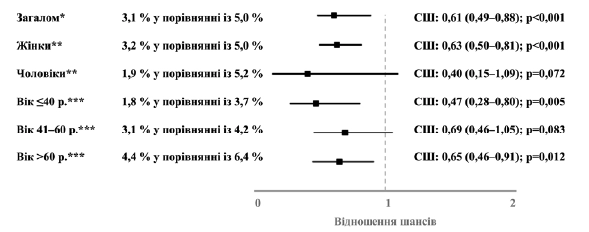
Рисунок 3. Взаємозв’язок між призначенням Канефрону® та ймовірністю виникнення частих рецидивних ІСШ (Канефрон® у порівнянні з антибіотиком). *Багатопараметрична логістична регресія з поправкою на вік та стать пацієнта, покриття медичним страхуванням, спеціальність лікаря амбулаторії та ІКЧ. ** Багатопараметрична логістична регресія з поправкою на вік пацієнта, покриття медичним страхуванням, спеціальність лікаря амбулаторії та ІКЧ. *** Багатопараметрична логістична регресія з поправкою на стать пацієнта, покриття медичним страхуванням, спеціальність лікаря амбулаторії та ІКЧ.
3.4. Тривалість тимчасової непрацездатності у зв’язку з інфекцією сечовивідних шляхів
Усього 16,9 % пацієнтів, яким було призначено Канефрон®, та 18,2 % пацієнтів, яким було призначено антибіотики, взяли щонайменше 3 дні лікарняного у зв’язку з ІСШ. Не спостерігалося значущого взаємозв’язку між призначенням Канефрону® та шансами на те, що пацієнт візьме лікарняний (СШ: 0,99; 95 % ДІ: 0,86–1,14; p = 0,931); крім того, жодного такого взаємозв’язку не спостерігалося у проаналізованих підгрупах (рисунок
4). В якості аналізу чутливості проводилося вивчення взаємозв’язку між призначенням Канефрону® та ймовірністю того, що пацієнт візьме лікарняний щонайменше на 7, 10 або 14 днів. Не спостерігалося жодних значущих взаємозв’язків у моделях багатопараметричної регресії; не було знайдено жодних відмінностей між когортами
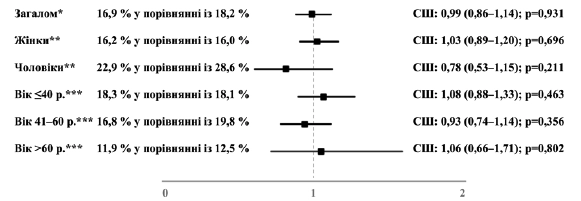
Рисунок 4. Взаємозв’язок між призначенням Канефрону® та ймовірністю того, що пацієнт візьме лікарняний тривалістю щонайменше 3 дні (Канефрон® у порівнянні з антибіотиком). *Багатопараметрична логістична регресія з поправкою на вік та стать пацієнта, покриття медичним страхуванням, спеціальність лікаря амбулаторії та ІКЧ. ** Багатопараметрична логістична регресія з поправкою на вік пацієнта, покриття медичним страхуванням, спеціальність лікаря амбулаторії та ІКЧ. *** Багатопараметрична логістична регресія з поправкою на стать пацієнта, покриття медичним страхуванням, спеціальність лікаря амбулаторії та ІКЧ
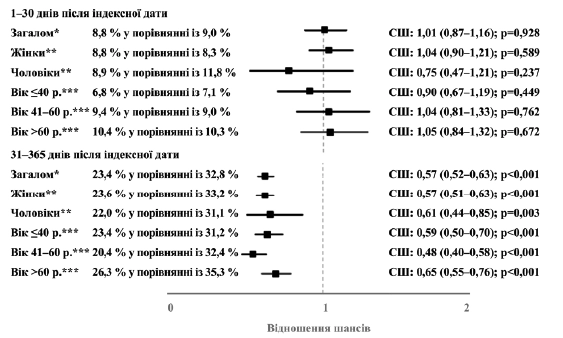
Рисунок 5. Взаємозв’язок між призначенням Канефрону® та ймовірністю призначення антибіотику у період 31–365 днів або 1–30 днів після індексної дати (Канефрон® у порівнянні з антибіотиком). *Багатопараметрична логістична регресія з поправкою на вік та стать пацієнта, покриття медичним страхуванням, спеціальність лікаря амбулаторії та ІКЧ. ** Багатопараметрична логістична регресія з поправкою на вік пацієнта, покриття медичним страхуванням, спеціальність лікаря амбулаторії та ІКЧ. *** Багатопараметрична логістична регресія з поправкою на стать пацієнта, покриття медичним страхуванням, спеціальність лікаря амбулаторії та ІКЧ.
Канефрону® та антибіотикотерапії (СШ: 1,01 (95 % ДІ: 0,85‒1,19; p = 0,949) для терміну ≥7 днів: СШ: 1,04 (95 % ДІ: 0,86‒1,25; p = 0,703) для терміну ≥10 днів, СШ: 1,06 (95 % ДІ: 0,86‒1,31; p = 0,584) для терміну ≥14 днів.
3.5. Додаткове призначення антибіотиків після індексної дати
Протягом 31–365 днів після індексної дати у 23,4% пацієнтів, яким було призначено Канефрон®, та у 32,8% пацієнтів, яким було призначено антибіотики, мало місце принаймні одне нове (повторне) призначення антибіотиків. Призначення Канефрону® асоціювалося зі значуще нижчими шансами призначення антибіотиків протягом 31–365 днів після індексної дати (СШ: 0,57; 95 % ДІ: 0,52‒0,63; p < 0,001). Цей взаємозв’язок спостерігався у всіх досліджуваних підгрупах (рисунок 5). При цьому, однак, не спостерігалося жодного взаємозв’язку між призначенням Канефрону® та призначенням антибіотиків у термін 1–30 днів після індексної дати (СШ: 1,01; 95 % ДІ: 0,87‒1,16; p=0,921).
3.6. Частота виникнення пієлонефриту
Протягом терміну тривалістю до 3 років після індексної дати пієлонефрит виникав відносно рідко. Наявність пієлонефриту на початку було задокументовано у 1,6% пацієнтів з групи Канефрону® та у 1,5 % пацієнтів з групи антибіотикотерапії; за даними аналізу на підставі багатопараметричної регресії Кокса, жодного значущого взаємозв’язку не спостерігалося (співвідношення шансів (СШ): 1,00; 95 % ДІ: 0,67–1,48; p=0,954).
4. Обговорення
Наскільки нам відомо, це перше неінтервенційне дослідження в реальних умовах, проведене у Німеччині, яке доводить, що монотерапія препаратом Канефрон® насправді «працює» в якості симптоматичного лікування ІСШ. Отримані дані підтверджують ту важливу роль, яку препарат Канефрон® відіграє у зменшенні застосування антибіотиків та послабленні антибіотикорезистентності.
Представлені результати не є чимось неочікуваним, оскільки Канефрон® — це добре досліджений та затверджений лікарський засіб. Amdii et al. раніше дійшли висновку, що лікування препаратом Канефрон® Н дозволяє скоротити застосування антибіотиків у жінок із нІСШ 25. Дослідницька група Wagenlehner et al. провела дослідження фази III для демонстрації не меншої ефективності, у якому взяли участь 659 жінок. Автори виявили відмінність щодо відсоткової частки жінок, які потребували додаткової антибактеріальної терапії, між пацієнтами, які отримували Канефрон® Н, та пацієнтами, що отримували антибіотики; при цьому дана відмінність свідчила про не меншу ефективність досліджуваного препарату 21. У нашому дослідженні аналіз за показником «додаткове призначення антибіотиків» проводився для двох часових періодів (1–30 днів та 31–365 днів після встановлення діагнозу ІСШ). Протягом періоду 1–30 днів не спостерігалося жодних значущих відмінностей між препаратом Канефрон® та антибіотикотерапією. Ці дані підтверджують результати клінічного дослідження, проведеного Wagenlehner et al. 21 в реальних умовах. Що ж до періоду 31–365 днів, частота додаткового призначення антибіотиків після лікування Канефроном® була значуще нижчою у порівнянні з антибіотикотерапією.
У декількох клінічних дослідженнях було описано профілактичний ефект препарату Канефрон® Н, що застосовувався в якості комбінованої або монотерапії у пацієнтів, які страждають від ІСШ 26-30.
У наступному клінічному дослідженні за авторством Davidov та Bunova проводилася порівняльна оцінка ефективності та безпечності монотерапії препаратом Канефрон® Н та антибіотикотерапії (ципрофлоксацин) при лікуванні гострого циститу легкого ступеня у 160 жінок 19. Через 6 днів лікування клінічні симптоми повністю зникли у 66 (82,5 %) пацієнтів в групі Канефрону® Н та у 68 (85,0 %) пацієнтів в групі антибіотикотерапії. Рецидиви циститу протягом одного року спостерігалися у 5 % пацієнтів в групі Канефрону® Н та у 12,5 % пацієнтів в групі антибіотикотерапії 19. Цікаво зазначити, що RWD вказує на те, що у всіх пацієнтів застосування Канефрону® характеризувалося не лише значуще нижчим ризиком спорадичного рецидивування ІСШ, але навіть значуще нижчим ризиком виникнення частих рецидивних ІСШ.
Канефрон® — не лише ефективний засіб для лікування ІСШ, але й добре переноситься 31. На відміну від антибіотиків, цей лікарський засіб рослинного походження не має негативного впливу на мікробіоту кишечника порівняно із такими препаратами, як фосфоміцин або нітрофурантоїн 32. Цей ефект стає особливо помітним у міру того, як дослідження мікробіому сечовивідних шляхів показують, що безсимптомна бактеріурія ймовірно має захисну дію при ІСШ 33 та може розглядатися в якості методу профілактичного лікування при рецидивних інфекціях 34. Представлені нами результати підтверджують цей висновок, оскільки застосування антибіотикотерапії асоціювалося зі значуще вищою ймовірністю подальшого призначення антибіотиків в період 31–365 днів.
З метою зменшити кількість призначень антибіотиків, протягом останніх років проводилося вивчення декількох лікарських засобів, що не є антибіотиками, таких як нестероїдні протизапальні препарати (НПЗП) 8-10 або різні препарати з рослинними компонентами, такі як Ангоцин® 11. У порівнянні з НПЗП Канефрон® не тільки має знеболювальний/протизапальний ефект, але й чинить дію різними способами для полегшення симптомів завдяки кільком компонентам лікарської суміші (1:1:1), до складу якої входять трава золототисячнику, корінь любистку та листя розмарину. Завдяки своїй спазмолітичній 14, протизапальній та знеболювальній 18 дії, Канефрон® має потенціал для зменшення симптомів, пов’язаних із гострими нІСШ у нижніх відділах сечовивідних шляхів, таких як запальний біль, спазм та часте сечовипускання. Крім того антиадгезивна дія 17 сприяє усуненню бактерій з сечовивідних шляхів. У нашому ретроспективному дослідженні показано, що серед лікарів існує певний ступінь сприйняття засобів, що не є антибіотиками, оскільки у клінічній практиці майже третина пацієнтів (31,3 %) не отримувала антибіотикотерапії. У понад 2320 із цих випадків проводилося лікування препаратом Канефрон® в якості монотерапії. ЛЗП призначали Канефрон® частіше, ніж гінекологи або урологи. Це відображає той факт, що у Німеччині пацієнти, які страждають на нІСШ, в першу чергу звертаються до ЛЗП.
Пієлонефрит може виникати в якості ускладнення у 0,3 % – 0,5 % випадків інфекцій сечовивідних шляхів 8,10. Попри наявність повідомлень про вищу частоту виникнення пієлонефриту на тлі застосування альтернативних засобів, що не є антибіотиками 8,10,21, результати ретроспективного довгострокового аналізу даних подальшого спостереження вказують на те, що засоби, що не є антибіотиками, не чинять негативного впливу щодо частоти виникнення пієлонефриту 9. У нашому дослідженні також не було виявлено жодного значущого взаємозв’язку між застосуванням Канефрону® та частотою виникнення пієлонефриту. Крім цього, тривалість тимчасової непрацездатності, зумовленої ІСШ, при застосуванні препарату Канефрон® була такою ж, як при застосуванні антибіотикотерапії.
Ці результати підтверджують гіпотезу про те, що симптоматичну терапію препаратом Канефрон® слід використовувати переважно при лікуванні нІСШ у нижніх відділах сечовивідних шляхів натомість «апріорного» застосування антибіотикотерапії.
До сильних сторін даного дослідження відносяться великий масив даних (понад 2300 пацієнтів, що отримували Канефрон®, та понад 158 000 пацієнтів, що отримували антибіотики), який включав пацієнтів жіночої та чоловічої статі, а також різні вікові групи та спеціальності лікарів. Крім того, у нашому дослідженні використовувалася німецька база даних IMS® DA, надійність якої було підтверджено декількома клінічними дослідженнями; отже, це свідчить про надійність одержаних нами результатів 22,23.
Використовувана нами база даних IMS®DA володіє певними особливими характеристиками, які необхідно взяти до уваги. По-перше, оцінки залежать від кодів МКХ, які вводять у систему ЛЗП, лікарі-урологи та лікарі-гінекологи. Ці коди проходять процес перевірки та підтвердження, який здійснює власник бази даних IMS®DA (компанія «IQVIA»). Проте коди МКХ не дають можливості провести диференціацію між ускладненими та неускладненими діагнозами. По-друге, кількість пацієнтів, що одержували лікування Канефроном®, була помітно нижчою у порівнянні з кількістю пацієнтів, які лікувалися антибіотиками. Менша кількість призначень лікарських засобів рослинного походження може бути зумовлена їх реєстраційним статусом в Німеччині, де вони є безрецептурними (OTC) препаратами, у той час як антибіотики — рецептурними. Ця база даних не містить даних щодо використання лікарських засобів рослинного походження, які пацієнти придбали без рецепту. Те саме стосується НПЗП. Можливо, лікарі вирішили не призначати жодних препаратів пацієнтам із ІСШ дуже легкого ступеня або лише надавали їм рекомендації щодо безрецептурних препаратів, які пацієнти могли б згодом купити в аптеках самостійно. Крім того, не були доступні дані щодо соціально-економічного статусу пацієнтів та факторів ризику, зумовлених способом життя (куріння, вживання алкоголю, фізична активність тощо). До того ж, пацієнта можна відстежити лише у єдиній приватній практиці/амбулаторії; якщо йому встановлює діагноз або виписує ліки інший лікар, такі призначення не документуються.
Щоб зменшити ймовірність систематичної помилки, на додачу до поправок, внесених до моделей регресії, було окремо побудовано моделі регресії для трьох вікових груп, для чоловіків та для жінок.
На завершення слід зазначити, що дане дослідження виявило, що в реальних умовах Канефрон® вже застосовується в якості монотерапії для лікування ІСШ. Більше того, попри притаманні використовуваній базі даних обмеження, одержані результати вказують на те, що симптоматичне лікування препаратом Канефрон® в якості монотерапії є ефективним та безпечним. При застосуванні препарату Канефрон® частота виникнення спорадичних та частих рецидивів ІСШ була навіть значуще меншою порівняно з антибіотикотерапією. Таким чином, симптоматична терапія неускладнених інфекцій нижніх відділів сечовивідних шляхів рослинним лікарським засобом Канефрон® рекомендується з метою зменшення частоти призначень антибіотиків за цим показанням.
5. Висновки
Наведені вище дані з реальної практики вказують на те, що Канефрон® — ефективний та безпечний засіб симптоматичної терапії гострого циститу або ІСШ. В довгостроковій перспективі показники частоти додаткового призначення антибіотиків та рецидивів ІСШ після лікування препаратом Канефрон® були навіть значуще нижчими, ніж після лікування антибіотиками. Таким чином, препарат Канефрон® варто розглядати в якості альтернативного засобу лікування; зокрема, зважаючи на необхідність ширшого впровадження стратегії раціонального використання протимікробних препаратів.
Особистий внесок авторів: Автор K.K. займався розробкою дизайну дослідження, провів статистичний аналіз, займався літературним пошуком, написав перший чорновий варіант рукопису та займався коректурою рукопису. Автори M.H., H.S., D.A.-S., F.W., K.G.N. займалися розробкою дизайну дослідження, літературним пошуком та коректурою рукопису. Усі автори прочитали опубліковану версію рукописи та погодили її.
Фінансування: Проведення цього дослідження фінансувалося компанією «Біонорика СЕ» (м. Ноймаркт, Німеччина).
Заява щодо етичних аспектів проведення дослідження: Законодавство Німеччини за певних умов дозволяє використання з дослідницькою метою анонімних даних електронної медичної документації. Згідно з цим законодавством, для проведення такого типу обсерваційного дослідження, що не передбачає використання даних, які могли б безпосереднім чином ідентифікувати пацієнта, немає необхідності одержувати інформовану згоду від пацієнтів чи дозвіл відповідної експертної ради закладу охорони здоров’я (ЕРЗ). Оскільки дані щодо пацієнтів запитувалися лише у сукупному вигляді та у відповідь на такі запити не надавалося жодної конфіденційної медичної інформації, для користування цією базою даних та для проведення даного дослідження не вимагалося жодних дозволів від ЕРЗ.
Заява про надання інформованої згоди: Н/З.
Заява про наявність даних: Дані, представлені в цьому дослідженні, доступні за запитом у відповідного автора.
Конфлікт інтересів: Автори Martina Höller, Hubert Steindl, Dimitri Abramov-Sommariva є штатними працівниками компанії «Біонорика СЕ»; автор Karel Kostev є штатним працівником компанії IQVIA та не декларує жодних інших конфліктів інтересів. Автор Kurt G. Naber повідомляє про одержання персональної винагороди від компанії «Біонорика», а також про одержання персональної винагороди від компанії «Adamed», персональної винагороди від компанії «Allecra», персональної винагороди від компанії «Apogepha», персональної винагороди від компанії «Enteris Biopharma», персональної винагороди від компанії «Galenus», персональної винагороди від компанії «GlaxoSmithKline», персональної винагороди від компанії «Hermes», персональної винагороди від компанії «Leo», персональної винагороди від компанії «Medice», персональної винагороди від компанії «MerLion», персональної винагороди від компанії «MSD SHARP& DOHME», персональної винагороди від компанії «Paratek», персональної винагороди від компанії «Roche», персональної винагороди від компанії «Rosen», персональної винагороди від компанії «Saxonia» та персональної винагороди від компанії «Vifor», що не стосується даної поданої роботи. FW повідомляє про одержання персональної винагороди від компанії «Біонорика», а також про одержання персональної винагороди та інших коштів від компанії «Achaogen», персональної винагороди від компанії «AstraZeneca», інших коштів від компанії «Enteris BioPharma», інших коштів від компанії «Helperby Therapeutics Ltd.», персональної винагороди від компанії «Janssen», персональної винагороди від компанії «LeoPharma», персональної винагороди від компанії «MerLion», персональної винагороди від компанії «MSD», персональної винагороди від компаній «OM Pharma/Vifor Pharma», персональної винагороди від компанії «Pfizer», персональної винагороди від компанії «RosenPharma», персональної винагороди та інших коштів від компанії «Shionogi», персональної винагороди від компанії «VenatoRx та персональної винагороди від компанії «GSK», що не стосується даної поданої роботи.
Список літератури
Flores-Mireles, A.L.; Walker, J.N.; Caparon, M.; Hultgren, S.J. Urinary tract infections: Epidemiology, mechanisms of infection and treatment options. Nat. Rev. Microbiol. 2015, 13, 269‒284. [CrossRef] [PubMed]
Schmiemann, G.; Kniehl, E.; Gebhardt, K.; Matejczyk, M.M.; Hummers, E. The Diagnosis of Urinary Tract Infection. Dtsch. Aerzteblatt Online 2010, 107, 361‒367. [CrossRef] [PubMed]
Foxman, B. Epidemiology of urinary tract infections: Incidence, morbidity, and economic costs. Am. J. Med. 2002, 113, 5‒13. [CrossRef]
Colgan, R.; Williams, M. Diagnosis and treatment of acute uncomplicated cystitis. Am. Fam. Physician 2011, 84, 771‒776.
Bonkat, G.; Bartoletti, R.; Bruyère, F.; Cai, T.; Geerlings, S.E.; Köves, B.; Schubert, S.; Wagenlehner, F.; Mezei, T.; Pilatz, A.; et al. European Association of Urology Guidelines on Urological Infections; EAU Guidelines Office: Arnhem, The Netherlands, 2020; ISBN 978-94-92671-07-3. Available online: https://uroweb.org/guideline/urological-infections/ (accessed on 4 January 2021).
Kranz, J.; Schmidt, S.; Lebert, C.; Schneidewind, L.; Mandraka, F.; Kunze, M.; Helbig, S.; Vahlensieck, W.; Naber, K.; Schmiemann, G.; et al. The 2017 Update of the German Clinical Guideline on Epidemiology, Diagnostics, Therapy, Prevention, and Management of Uncomplicated Urinary Tract Infections in Adult Patients. Part II: Therapy and Prevention. Urol. Int. 2018, 100, 271‒278. [CrossRef]
Christiaens, T.C.M.; De Meyere, M.; Verschraegen, G.; Peersman, W.; Heytens, S.; De Maeseneer, J.M. Randomised controlled trial of nitrofurantoin versus placebo in the treatment of uncomplicated urinary tract infection in adult women. Br. J. Gen. Pract. 2002, 52, 729‒734. [PubMed]
Gagyor, I.; Bleidorn, J.; Kochen, M.M.; Schmiemann, G.; Wegscheider, K.; Hummers-Pradier, E. Ibuprofen versus fosfomycin for uncomplicated urinary tract infection in women: Randomised controlled trial. BMJ 2015, 351, h6544. [CrossRef] [PubMed]
Bleidorn, J.; Hummers-Pradier, E.; Schmiemann, G.; Wiese, B.; Gágyor, I. Recurrent urinary tract infections and complications after symptomatic versus antibiotic treatment: Follow-up of a randomised controlled trial. Ger. Med. Sci. 2016, 14. [CrossRef]
Kronenberg, A.; Bütikofer, L.; Odutayo, A.; Mühlemann, K.; Da Costa, B.R.; Battaglia, M.; Meli, D.N.; Frey, P.; Limacher, A.; Reichenbach, S.; et al. Symptomatic treatment of uncomplicated lower urinary tract infections in the ambulatory setting: Randomised, double blind trial. BMJ 2017, 359, j4784. [CrossRef]
Stange, R.; Schneider, B.; Albrecht, U.; Mueller, V.; Schnitker, J.; Michalsen, A. Results of a randomized, prospective, double-dummy, double-blind trial to compare efficacy and safety of a herbal combination containing Tropaeoli majoris herba and Armoraciae rusticanae radix with co-trimoxazole in patients with acute and uncomplicated cystitis. Res. Rep. Urol. 2017, 9, 43‒50. [CrossRef]
Wawrysiuk, S.; Naber, K.; Rechberger, T.; Miotla, P. Prevention and treatment of uncomplicated lower urinary tract infections in the era of increasing antimicrobial resistance—non-antibiotic approaches: A systemic review. Arch. Gynecol. Obstet. 2019, 300, 821‒828. [CrossRef] [PubMed]
Naber, K.G. Efficacy and safety of the phytotherapeutic drug Canephron® N in prevention and treatment of urogenital and gestational disease: Review of clinical experience in Eastern Europe and Central Asia. Res. Rep. Urol. 2013, 5, 39‒46. [CrossRef]
Brenneis, C.; Künstle, G.; Haunschild, J. Spasmolytic activity of Canephron N on the contractility of rat and human isolated urinary bladder. In Proceedings of the 13th Congress of the International Society for Ethnopharmacology, Graz, Austria, 2‒6 September 2012.
Haloui, M.; Louedec, L.; Michel, J.-B.; Lyoussi, B. Experimental diuretic effects of Rosmarinus officinalis and Centaurium erythraea. J. Ethnopharmacol. 2000, 71, 465‒472. [CrossRef]
Nausch, B.; Künstle, G.; Mönch, B.; Koeberle, A.; Werz, O.; Haunschild, J. Canephron® N alleviates pain in experimental cystitis and inhibits reactive oxygen/nitrogen species as well as microsomal prostaglandin E2 synthase-1. Der Urol. 2015, 54, 28.
Künstle, G.; Brenneis, C.; Haunschild, J. 671 Efficacy of Canephron® N against bacterial adhesion, inflammation and bladder hyperactivity. Eur. Urol. Suppl. 2013, 12, e671. [CrossRef]
Nausch, B.; Pace, S.; Pein, H.; Koeberle, A.; Rossi, A.; Künstle, G.; Werz, O. The standardized herbal combination BNO 2103 contained in Canephron® N alleviates inflammatory pain in experimental cystitis and prostatitis. Phytomedicine 2019, 60, 152987. [CrossRef]
Davidov, M.I.; Bunova, N.E. Comparative assessment of Canephron® N and ciprofloxacin as monotherapy of acute uncomplicated cystitis in women. Urologiia 2018, 4, 24‒32. [CrossRef]
Davidov, M.I.; Voitko, D.A.; Bunova, N.E. Treatment of acute uncomplicated cystitis in women with antibiotic allergy or intolerance. Urologiia 2019, 5, 64‒71. [CrossRef]
Wagenlehner, F.M.; Abramov-Sommariva, D.; Höller, M.; Steindl, H.; Naber, K.G. Non-Antibiotic Herbal Therapy (BNO 1045) versus Antibiotic Therapy (Fosfomycin Trometamol) for the Treatment of Acute Lower Uncomplicated Urinary Tract Infections in Women: A Double-Blind, Parallel-Group, Randomized, Multicentre, Non-Inferiority Phase III Trial. Urol. Int. 2018, 101, 327‒336. [CrossRef]
Haynes, B. Can it work? Does it work? Is it worth it? The testing of healthcare interventions is evolving. BMJ 1999, 319, 652‒653. [CrossRef] [PubMed]
Rathmann, W.; Bongaerts, B.; Carius, H.-J.; Kruppert, S.; Kostev, K. Basic characteristics and representativeness of the German Disease Analyzer database. Int. J. Clin. Pharmacol. Ther. 2018, 56, 459‒466. [CrossRef]
Quan, H.; Sundararajan, V.; Halfon, P.; Fong, A.; Burnand, B.; Luthi, J.C.; Saunders, L.D.; Beck, C.A.; Feasby, T.E.; Ghali, W.A. Coding algorithms for defining comorbidities in ICD-9-CM and ICD-10 administrative data. Med. Care 2005, 43, 1130‒1139. [CrossRef]
Amdii, R.E.; Al-Shukri, S.K.; Kuzmin, I.V.; Sorokin, N.V.; Chaplitskiy, E.A.; Skvortsov, M.V.; Alekseev, A.S.; Okunchaev, A.S.; Turbin, A.A.; Timaeva, G.R.; et al. Use of Canephron N in treatment of acute uncomplicated cystitis in women. Urologicheskie Vedomosti 2016, 6, 16‒22. [CrossRef]
Sabadash, M.; Shulyak, A. Canephron® N in the treatment of recurrent cystitis in women of child-bearing Age: A randomised controlled study. Clin. Phytoscience 2017, 3, 9. [CrossRef]
Serov, V.N.; Baranov, I.I.; Protopopova, N.V.; Tkachenko, L.V.; Kukarskaya, I.I. Evaluation of experience with a combination phytotherapeutic drug in pregnant women (a multicenter retrospective observational study). Obstet. Gynecol. 2013, 9, 105‒112.
Dudar, I.O.; Loboda, O.M.; Krot, V.F.; Khimich, V.I.; Kryzhanivska, V.M.; Bryzhachenko, T.P. A 12-month comparative study of Canephron® N administration in the treatment of patients with the urinary tract infection. Zdorovie Muzhchiny 2010, 3, 85‒90.
Ordzhonikidze, N.V.; Yemelyanova, A.I.; Petrova, S.B. Complication prevention and treatment in pregnants and puerperants with urinary tract diseases. Obstet. Gynaecol. 2009, 6, 41‒45.
Perepanova, T.S.; Khazan, P.L. Phytopreparation Canephron® N in the treatment and prophylaxis of urinary tract infections. Vrachebnoye Soslovie 2005, 5, 44‒46.
Ivanov, D.; Abramov-Sommariva, D.; Moritz, K.; Eskötter, H.; Kostinenko, T.; Martynyuk, L.; Kolesnik, N.; Naber, K.G. An open label, non-controlled, multicentre, interventional trial to investigate the safety and efficacy of Canephron® N in the management of uncomplicated urinary tract infections (uUTIs). Clin. Phytoscience 2015, 1, 7. [CrossRef]
Naber, K.G.; Kogan, M.; Wagenlehner, F.M.E.; Siener, R.; Gessner, A. How the microbiome is influenced by the therapy of urological diseases: Standard versus alternative approaches. Clin. Phytoscience 2017, 3, 8. [CrossRef]
Cai, T.; Verze, P.; Palmieri, A.; Gacci, M.; Lanzafame, P.; Malossini, G.; Nesi, G.; Bonkat, G.; Wagenlehner, F.M.; Mirone, V.; et al. Is Preoperative Assessment and Treatment of Asymptomatic Bacteriuria Necessary for Reducing the Risk of Postoperative Symptomatic Urinary Tract Infections After Urologic Surgical Procedures? Urology 2017, 99, 100‒105. [CrossRef]
Wullt, B.; Svanborg, C. Deliberate Establishment of Asymptomatic Bacteriuria—A Novel Strategy to Prevent Recurrent UTI. Pathogens 2016, 5, 52. [CrossRef]
Martin, D.; Konrad, M.; Adarkwah, C.C.; Kostev, K. Reduced antibiotic use after initial treatment of acute respiratory infections with phytopharmaceuticals- a retrospective cohort study. Postgrad. Med. 2020, 132, 412‒418. [CrossRef] [PubMed]
